фолдинг и тд «фолдинг белков — Процесс сворачивания полипептидной цепи в правильную пространственную структуру. Индивидуальные белки, продукты одного гена, имеют идентичную аминокислотную последовательность и приобретают в одинаковых условиях клетки одинаковую конформацию и функцию. для многих белков, имеющих сложную пространственную структуру, фолдинг протекает при участии «шаперонов»
Ренативация рибонуклеазы. процесс денатурации белков может быть обратимым. Это открытие было сделано при изучении денатурации рибонуклеазы — расщепляющего связи между нуклеотидами в РНК. Рибонуклеаза — глобулярный белок, содержащий одну полипептидную цепь, состоящую из 124 аминокислотных остатков. Его конформацию стабилизируют 4 дисульфидные и множество слабых связей.
Обработка рибонуклеазы меркаптоэтанолом приводит к разрыву дисульфидных связей и восстановлению SH-групп цистеиновых остатков, что нарушает компактную структуру белка. Добавление мочевины или гуанидинхлорвдаиприводит к образованию случайным образом свёрнутых полипептидных цепей рибонуклеазы, лишённых . денатурации фермента. если путём диализа очистить рибонуклеазу от денатурирующих агентов и меркаптоэтанола, ферментативная активность белка постепенно восстанавливается. Этот процесс называется ренатурацией
Первичная структура белка
Возможность ренативации доказана и для других белков. необходимое условие для восстановления его конформации — целостность первичной структуры белка.
белки, способные связываться с белками, находящимися в неустойчивом, склонном к агрегации состоянии,способные стабилизировать их конформацию, обеспечивая фолдинг белков получили название «шапероны».
Роль шаперонов в фолдинге белков
в период синтеза белка на рибосоме защиту реакционно-способных радикалов осуществляют Ш-70.Фолдинг многих высокомолекулярных белков, имеющих сложную конформацию осуществляется в пространстве, сформированном Ш-60. Ш-60 функционируют в виде олигомернoго комплекса, состоящего из 14 субъединиц. Шапероновый комплекс имеет высокое сродство к белкам, на поверхности которых есть участки, обогащённые гидрофобными радикалами). Попадая в полость шаперонового комплекса, белок связывается с гидрофобными радикалами апикальных участков Ш-60.
Роль шаперонов в защите белков клеток от денатурирующих стрессовых воздействий
Шапероны, участвующие в защите клеточных белков от денатурирующих воздействий, относят к белкам теплового шока.При действии (высокая температура, гипоксия, инфекция, УФО, изменение рН среды, изменение молярности среды, действие токсичных химических веществ, тяжёлых металлов) в клетках усиливается синтез БТШ. они могут препятствовать их полной денатурации и восстанавливать нативную конформацию белков.
Болезни, связанные с нарушением
фолдинга белков Болезнь Альцхаймера- амилоидоз нервной системы, поражающий лиц преклонного возраста и характеризующийся прогрессирующим расстройством памяти и полной деградацией личности. В ткани мозга откладывается амилоид — белок, образующий нерастворимые фибриллы, нарушающие структуру и функции нервных клеток.
Трансляция. Часть 6. «Фолдинг белков»
Источник: www.studwood.net
Фолдинг белков
Функционально активные белки образуются в результате посггрансляционных модификаций полипе!гтидных цепей, синтезированных на рибосомах. Эти модификации включают:
- 2) Модификации аминокислот— карбоксилирование, фосфорилирование, йодирование, гидроксилирование, ацилирование и гликозилирование.
- 3) Формирование пространственной структуры, или фолдинг; в котором принимают участие белки-шапероны, обеспечивающие правильную укладку полипептидной цепи.
- 4) Образование дисульфидных связей между остатками цистеина, участвующими в формировании трёхмерной структуры белка.
- 5) 11рисоединение простетических групп.
- 6) Образование олигомерных структур, которое также осуществляется при участии шаперонов.
Фолдинг- это процесс сворачивания пептидной цепи в правильную трёхмерную структуру. Если белок состоит из нескольких субъединиц, то фолдинг включает и объединение последних в единую макромолекулу. Для фолдинга необходимы специальные белки — шяпероны и ферменты фолдязы. Они не определяют то, какой должна быть пространственная конфигурация белка, но создают возможность для быстрого её формирования.
Выделяют две модели сворачивания белков.
Модель промежуточных состояний (рис. 6.9).
Фолдинг белка совершается не одномоментно, а в несколько стадий.
- 1. Исходная форма глобулярного белка (непосредственный продукт трансляции) — случайный клубок, или развёрнутая пептидная цепь. Характеризуется отсутствием вторичной и третичной структуры.
- 2. Состояние — предшественник расплавленной глобулы. Вначале формируется вторичная структура — различные участки пептидной цепи образуют а-спирали, (3-структуры или остаются бесструктурными. По завершению этого процесса происходит сжимание клубка в так называемую расплавленную глобулу. Движущей силой сжатия является взаимодействие между радикалами аминокислот. Причём с помощью радикалов фактически взаимодействуют отельные элементы вторичной структуры. Однако в этой глобуле радикалы аминокислот ещё не нашли своих окончательных партнёров, не заняли «правильного» положения, взаимодействуют «с кем придётся». Поэтому общее количество одновременно существующих связей относительно не велико и связи, а сними, и конфигурация молекулы являются неустойчивыми.
- 3. Нативный белок— формируется термодинамически наиболее оптимальная структура, при которой между радикалами образуется максимально возможное количество связей. В случае достаточно больших белков вначале формируется третичная структура доменов, а затем последние занимают правильное положение друг относительно друга. Позже всего происходит связывание мономеров в олигомеры (если нативный белок состоит из нескольких субъединиц).
Модель сворачивания белков по принципу «всё или ничего».
У очень маленьких белков (до 100 аминокислотных остатков) промежуточные стадии (расплавленная глобула и состояние— предшественник) отсутствуют, и фолдинг проходит по принципу «всё ли ничего». Из-за малого числа аминокислотных остатков «неправильные» взаимодействия, лежащие в основе расплавленной глобулы, практически не случаются.
Поэтом> 7 нет сжатия клубка до образования нативной третичной структуры. В этих случаях фолдинг проходит следующим образом. Развёрнутая пептидная цепь в течение достаточно длительного времени существует без образования контактов между аминокислотными остатками, так как способные к взаимодействию остатки не сближаются друг с другом.
Затем случайно цепь достигает состояния, в котором может образоваться несколько «правильных», или нативных контактов. Тем самым как бы появляется ядро сворачивания (ядро нуклеации). После этого фолдинг завершается очень быстро. Наличие нескольких «правильных» связей удерживает цепь в такой конфигурации, в которой легко находят друг друга «правильные» пары. Например, белок химотрипсиновый ингибитор-2 (белок 02) включает 65 аминокислотных остатка, во вторичной структуре имеет одну а-спираль и 5 тяжей (3-структуры ((31. (35). Критическим моментом фолдинга этого белка является:
- 1) образование ос-спирали и тяжей (34, (35;
- 2) гидрофобное взаимодействие трёх аминокислотных остатков в составе этих элементов — Ала 16 (а-спираль), Лей49 ((34) и Иле59 ((35). Они участвуют в образовании ядра нуклеации.
В обеих моделях фолдинга важную роль играет феномен кооперативности — образование одной или нескольких «правильных» связей резко ускоряет замыкание других нативных связей.
А. С. Спирин выдвинул гипотезу о ко-трансляционном сворачивании белков. Согласно этой гипотезе фолдинг полипеп- тидной цепи происходит по мере её роста на рибосоме в направлении от N- к С-концу.
Доказательства ко-трансляционного сворачивания белков:
1) Фермент— протеи ндисульфидизомераза (ИДИ), катализирующий перемещение в новосинтезированных белках дисуль- фидных связей должна присутствовать во время трансляции (необходима для правильного замыкания дисульфидных связей). Показано на примере одной из цепей иммуноглобулина.

Рис. 6.9. Модель промежуточных состояний (по Наградовой Н. К, 1996)
2) При синтезе белковых субъединиц гемоглобина они приобретают способность связывать гем ещё до окончания трансляции — по достижении примерно ~/ъ своей полной длины. Следовательно, гем-связывающий центр формируется во время трансляции.
3) Фермент светлячков люцифераза оказывается активным сразу после образования на рибосоме. Следовательно, и в этом случае фолдинг произошёл во время трансляции.
Факторы фолдинга
Выделяют 2 группы факторов фолдинга:
- 1) белки с каталитической активностью — ферменты фолдинга или фолдазьг,
- 2) молекулярные i напероны.
Ферменты фолдинга
Протеиндисульфидизомераза (ПДИ) — катализирует перемещение в белках дисульфидных связей, то есть под её влиянием в сворачиваемом белке разрываются одни и вместо них замыкаются другие дисульфидные связи (рис. 6.10).
Если образовалась ошибочная S—S-связь, то в силу своей ковалентной природы она не может быть разорвана спонтанно, и поэтому полипептид будет зафиксирован в неправильной конфигурации. Разрушая и вновь образуя S—S-связи между различными остатками цистеина, ПДИ способствует коррекции фолдинга. Лабилизация дисульфидных связей в формирующемся белке даёт ему возможность найти (путём случайного перебора) такую комбинацию этих связей, которой соответствует энергетически наиболее оптимальная пространственная структура. Необходимость в ПДИ при фолдинге того или иного белка связана не с размером этого белка, а с количеством в нём S—S-мостиков.
В клетке ПДИ связана, в основном с эндоплазматическим ретикулумом и участвует в фолдинге белков, которые синтезируются мембраносвязаннымп рибосомами (например, мембранные белки, лизосомные белки).
Пептидилпролилизомераза (ПИИ). Среди 20 аминокислот, встречающихся в белке, есть пролин, а также продукт его гидрокенлнровання — гидроксипролин, которые являются иминокислотой (пх радикал связан не только с С а атомом, по и с азотом). Вместе, где располагается пролин в пептидной цепи не образуются ни а-спирали, ни (3-структуры, и пептидная цепь образует изгиб.
11ричём возможность изгиба определяется транс- и цис-конфигурацией радикала соседней аминокислоты и радикала пролина (рис. 6.11). Фермент ППИ катализирует переход радикалов в области пептидной связи пролина из транс- в цис-конфигурацию и обратно. При этом происходит временный разрыв данной пептидной связи, отчего становится возможным поворот вокруг её плоскости. После поворота связь снова замыкается.

Рис 6.10. Работа фермента протеиндисуяьфидизомеразы (по Награде вой Н. К, 1996)
Примечание: I. Схема действия протеиндисульфидизомеразы. Р — Сворачивающийся белок, Е — протепндисульфидпзомераза. А— Окисление SI 1-групп белка дисульфидной группой активного центра фермента: 1л — образование смешанного дисульфида, 2а — образование дисульфидного мостика в молекуле белка и восстановленной формы фермента. Б— Изомеризация дисульфидной группы в молекуле белка: 16— образование смешанного дисульфида, 26 — образование нового дисульфидного мостика в молекуле белка.
Таким образом, благодаря ППИ пептидная связь получает возможность делать в области остатка пролина такие изгибы, которые приводят к наиболее оптимальной пространственной структуре.

Рис. 6.11. Транс- и цис-конфигурация радикала пролит и paduKCLia соседней аминокислоты
Молекулярные шяпероны
Шапероны (HSP) выполняют разнообразные функции.
- 1) Обеспечение правильного фолдинга новообразованных белков: я) предупреждают агрегацию новых белков, то есть «неправильные» внешние взаимодействия в ходе фолдинга; б) предупреждают «неправильные» внутренние взаимодействия в пределах одной пептидной цепи; в) лабилизация слабых «неправильных» связей.
- 2) Контроль за рефолдингом. При стрессе некоторые белки клетки могут денатурировать. Такие белки могут подвергаться рефолдингу (ренатурировать) при активной помощи шапе- ронов.
- 3) Внутриклеточный транспорт белков. Так в лизосомы транспортируются белки, отслужившие свой срок, а в митохондрии повосинтезированные белки.
- 4) Поддержание ряда белков в определённой конформации — в состоянии как бы незавершённого фолдинга. Например, локализующийся в цитоплазме белковый рецептор к глюкокортикоидным гормонам (ГКГ) — в отсутствие ГКГ рецептор связан с комплексом шаперонов. В таком состоянии у рецептора закрыта (экранирована) так называемая ядерняя метка— та часть пептидной цепи, которая необходима для проникновения белка внутрь ядра. После связывания ГКГ с рецептором белки HSP диссоциируют, фолдинг завершается, и ядерная метка оказывается на поверхности. Поэтому рецептор проникает в ядро, переходит в димерную форму и связывается с определённым участком ДНК.
В последнее время показано, что у шаперонов имеются белковые помощники — ко-шапероны, молекулярная масса которых в несколько раз меньше. Взаимодействующие шаперон и ко- шаперон образуют единую систему. Например, в активный комплекс с HSP70 (молекулярная масса 70 kDa) входят следующие белки ко-шапероны HSP40 и HSP10.
Ко-шаперон HSP40 (молекулярная масса 40 kDa, в Е. coli — DnaJ) взаимодействуя с HSP70 способствует эффективным процессам фолдинга и ре- фолдинга и участвует в регуляции активности HSP70. Ко- шаперон HSP10 необходим для проявления шаперонной активности комплекса IIsp70-IIsp40 (DnaK-DnaJ), в Е. coli, — GrpE — «nucleotide exchange factor» (молекулярная масса — 10 кДа) (рис. 6.12).

Рис. 6.12. Механизм действия шаперонов HSP70 при рефоядинге белков (по Doyle S. et al, 2013)
Примечание: 1. HSP70 (DnaK в Е. Coli), связывающий ATP, слабо взаимодействует с неправильно свёрнутым белком; 2. Ко-шаперон HSP40 (DnaJ, содержащий J-домен) стимулирует HSP70 к гидролизу АТР, что запускает конформацнонные изменения и стабилизирует связывание с неправильно свёрнутым белком; 3. HSP10 (GrpE, «Nucleotide Exchange Factor») стимулирует нуклеотидный обмен IISP70 — HSP70 взаимодействует с АТР, приобретая низкую связывающую
активность; 4. Высвобождение белка в нативной конформации; 5. Если рефолдинг белка произошёл не до конца, он снова связывается с HSP70 и цикл рефолдинга повторяется.
Задания для внеаудиторной работы
1. Аминокислоты — мономерные звенья белков. Заполните таблицу «Свойства аминокислот»:
Источник: bstudy.net
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ
Доказано существование 4 уровней структурной организации белковой молекулы.
Первичная структура белка – последовательность расположения аминокислотных остатков в полипептидной цепи. В белках отдельные аминокислоты связаны друг с другом пептидными связями, возникающими при взаимодействии a-карбоксильных и a-аминогрупп аминокислот.
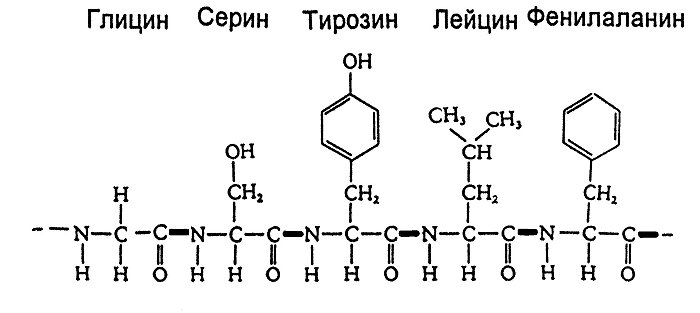
К настоящему времени расшифрована первичная структура десятков тысяч разных белков. Для определения первичной структуры белка методами гидролиза выясняют аминокислотный состав. Затем определяют химическую природу концевых аминокислот. Следующий этап — определение последовательности аминокислот в полипептидной цепи.
Для этого используют избирательный частичный (химический и ферментативный) гидролиз. Возможно применение рентгеноструктурного анализа, а также данных о комплементарной нуклеотидной последовательности ДНК.
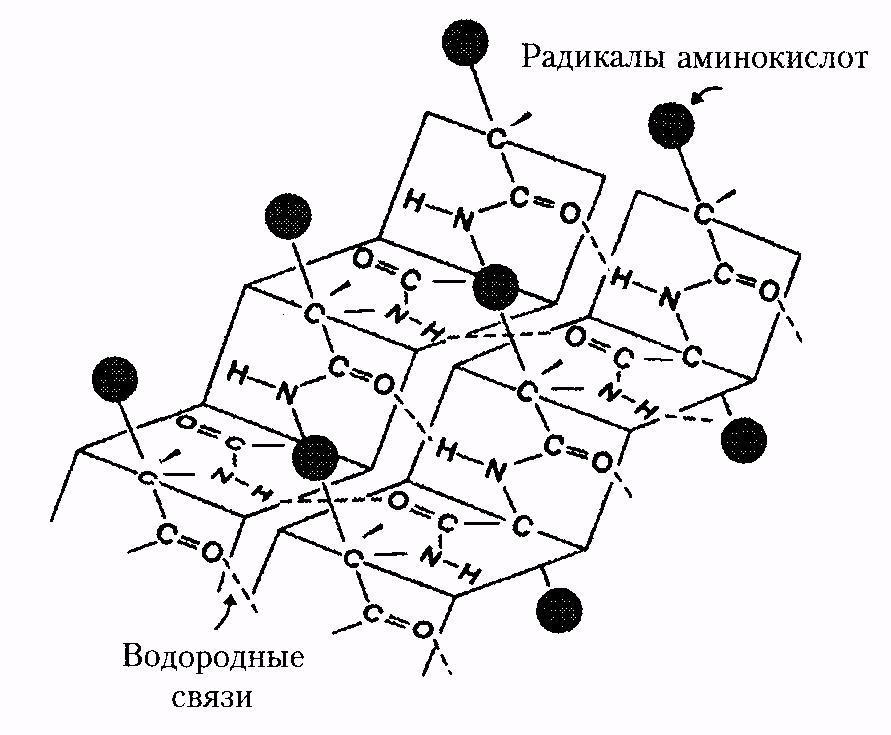
Вторичная структура белка – конфигурация полипептидной цепи, т.е. способ упаковки полипептидной цепи в определенную конформацию. Процесс этот протекает не хаотично, а в соответствии с программой, заложенной в первичной структуре.
Стабильность вторичной структуры обеспечивается в основном водородными связями, однако определенный вклад вносят ковалентные связи – пептидные и дисульфидные.
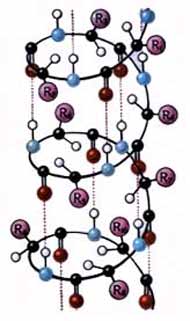
Наиболее вероятным типом строения глобулярных белков считают a-спираль. Закручивание полипептидной цепи происходит по часовой стрелке. Для каждого белка характерна определенная степень спирализации. Если цепи гемоглобина спирализованы на 75%, то пепсина-всего на 30%.
Тип конфигурации полипептидных цепей, обнаруженных в белках волос, шелка, мышц, получил название b-структуры. Сегменты пептидной цепи располагаются в один слой, образуя фигуру, подобную листу, сложенному в гармошку. Слой может быть образован двумя или большим количеством пептидных цепей.
 а а |
 б б |
| Рис. 1. Вторичная структура белка: а — a-спираль, б — b-структура. |
В природе существуют белки, строение которых не соответствует ни β-, ни a-структуре, например, коллаген — фибриллярный белок, составляющий основную массу соединительной ткани в организме человека и животных.
Третичная структура белка – пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Первый белок, третичная структура которого была выяснена рентгеноструктурным анализом — миоглобин кашалота (рис. 2).
В стабилизации пространственной структуры белков, помимо ковалентных связей, основную роль играют нековалентные связи (водородные, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, гидрофобные взаимодействия и т.д.).
По современным представлениям, третичная структура белка после завершения его синтеза формируется самопроизвольно. Основной движущей силой является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот погружаются внутрь белковой молекулы, а полярные радикалы ориентируются в сторону воды.
Процесс формирование нативной пространственной структуры полипептидной цепи называют фолдингом. Из клеток выделены белки, названные шаперонами. Они участвуют в фолдинге. Описан ряд наследственных заболеваний человека, развитие которых связывают с нарушением вследствие мутаций процесса фолдинга (пигментозы, фиброзы и др.).
Методами рентгеноструктурного анализа доказано существование уровней структурной организации белковой молекулы, промежуточных между вторичной и третичной структурами. Домен — это компактная глобулярная структурная единица внутри полипептидной цепи (рис. 3). Открыто много белков (например, иммуноглобулины), состоящих из разных по структуре и функциям доменов, кодируемых разными генами.
 |
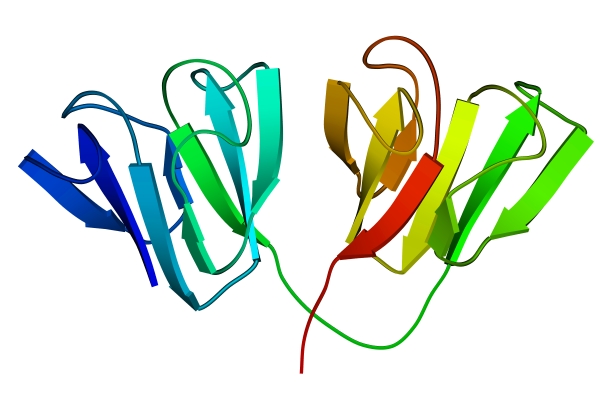 |
| Рис. 2. Третичная структура миоглобина | Рис. 3. Глобулярные домены в g-кристаллине (белке хрусталика глаза человека) |
Все биологические свойства белков связаны с сохранностью их третичной структуры, которую называют нативной. Белковая глобула не является абсолютно жесткой структурой: возможны обратимые перемещения частей пептидной цепи. Эти изменения не нарушают общей конформации молекулы. На конформацию молекулы белка оказывают влияние рН среды, ионная сила раствора, взаимодействие с другими веществами. Любые воздействия, приводящие к нарушению нативной конформации молекулы, сопровождаются частичной или полной потерей белком его биологических свойств.
Четвертичная структура белка — способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой или разной первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования.
Белковую молекулу, состоящую из нескольких полипептидных цепей, называют олигомером, а каждую входящую в него цепь — протомером. Олигомерные белки чаще построены из четного числа протомеров, например, молекула гемоглобина состоит из двух a- и двух b-полипептидных цепей (рис. 4).
Четвертичной структурой обладает около 5% белков, в том числе гемоглобин, иммуноглобулины. Субъединичное строение свойственно многим ферментам.
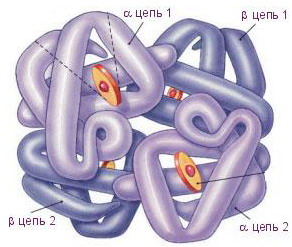 |
| Рис. 4. Молекула гемоглобина |
Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. Биологическую активность белок приобретает только при объединении входящих в его состав протомеров. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной.
Некоторые исследователи признают существование пятого уровня структурной организации белков. Это метаболоны -полифункциональные макромолекулярные комплексы разных ферментов, катализирующих весь путь превращений субстрата (синтетазы высших жирных кислот, пируватдегидрогеназный комплекс, дыхательная цепь).
Дата добавления: 2016-07-27 ; просмотров: 13559 ;
Источник: poznayka.org
