Известно достаточно большое число наследственных болезней, обусловленных изменением ДНК, которые однако не имеют менделевского характера наследования. Ниже будет рассмотрено митохондриальное наследование и митохондриальные болезни, а также импринтинг.
Митохондриальное наследование и митохондриальные болезни
Митохондрии являются клеточными органеллами. Митохондрии имеют две высокоспециализированные мембраны — наружную и внутреннюю, кольцевую молекулу ДНК, а также собственные системы транскрипции и трансляции. Каждая клетка содержит несколько сотен митохондрий. В них осуществляется ряд важных биохимических цепей реакций, из которых особенное значение имеют реакции энергетического обмена клетки.
Как уже отмечено, митохондрии имеют собственную ДНК, в каждой митохондрии содержится 10 и более молекул ДНК. Геном митохондриальной ДНК (мгДНК) полностью расшифрован.
Нарушение взаимодействия между митохондриальным и ядерным геномами служит причиной разнообразной митохондриальной патологии.
IN VIVO CLONING and RECOMBINANT DNA — A-level Biology. AQA topic 8 help is here!
Поскольку мтДНК содержится в цитоплазме клеток, она наследуется только по материнской линии. В цитоплазме яйцеклетки есть тысячи митохондрий и, следовательно, десятки тысяч молекул мтДНК. В то же время в сперматозоиде Имеется только несколько молекул мтДНК, которые не попадают в оплодотворяемое яйцо. Поэтому мужчины наследуют мтДНК от своих матерей, но не передают ее своим потомкам. Такой тип наследования называется материнским наследованием или наследованием по материнской линии.
Обычно все копии мтДНК идентичны, и такое состояние называют гомоплазмией. Иногда в мтДН К возникают мутации. Вследствие не очень совершенной работы митохондриальной ДНК-полимеразы и репаративных систем мутации в мтДНК возникают в 10 раз чаще, чем в ядерной ДНК. Появление мутации в одной из молекул мтДНК может привести к возникновению двух популяций мтДНК в клетке, что называют гетероплазией. В результате деления клеток мутантная мтДНК попадает в другие клетки, где она продолжает размножаться.
Энергетические потребности разных тканей организма различны. Наиболее энергопотребляющей является нервная система. Именно поэтому эта система в первую очередь поражается при митохондриальных болезнях.
Классификация митохондриальных болезней базируется на двух принципах:
1) участие мутантного белка в энергетических реакциях окислительного фосфорилирования;
2) кодируется ли мутантный белок мтДНК или ядерной ДНК.
К классу I митохондриальных болезней относится атрофия дисков зрительных нервов Лебера. Заболевание проявляется острой или подострой потерей центрального зрения, обусловленной атрофией зрительных нервов. Заболевание может начаться как в детском, так и в пожилом возрасте. У некоторых больных атрофия зрительных нервов сочетается с симптомами энцефаломиопатии. Атрофия зрительных нервов Лебера обусловлена мутациями в генах мтДНК, кодирующих субъединицы комплекса I.
К этому же классу относится синдром Лея (подострая некротизирующая энцефаломиелопатия). Синдром Лея возникает только тогда, когда мутантная мтДНК составляет не менее 90% всей мтДНК. Если же процент мутантной ДНК оказывается ниже, то проявляется синдром нейропатии, атаксии и пигментного ретинита.
Клонирование ДНК и рекомбинантная ДНК (видео 4) | Генная инженерия | Молекулярная генетика
Синдром нейропатии, атаксии и пигментной дистрофии сетчатки (NARP) может проявляться как в младенчестве, так и позже, вплоть до 2-го десятилетия жизни. Кроме патологии, вошедшей в название синдрома, у больных могут быть деменция, судороги, мотосенсорная нейропатия, тугоухость.
Синдром миоклонус-эпилепсии и рваных красных мышечных волокон (MERRF), который проявляется эпилепсией, деменцией, атаксией и миопатией, возникает в случае мутации в гене тРНК. Синдром может проявляться в детском и взрослом возрастах. Кроме указанных симптомов, при синдроме MERRF у больных иногда наблюдают нейросенсорную тугоухость, деменцию, атрофию зрительных нервов, спастическую диплегию. Обычно при этом синдроме выявляется выраженная гетероплазмия, поэтому экспрессивность синдрома резко варьирует.
Еще один синдром, обусловленный точковой заменой в гене тРНК, — это синдром митохондриальной энцефаломиопатии и инсультоподобных эпизодов (MELAS). При нем также наблюдается гетероплазмия, и, как следствие, экспрессивность синдрома довольно сильно варьирует. Основные клинические проявления включают энцефаломиопатию, инсультоподобные состояния, обычно преходящие, с восстановлением функции, судороги, атаксию, миоклонус-эпилепсию, мигренеподобные головные боли.
К митохондриальным заболеваниям, обусловленным делениями или дупликациями, относятся синдром Кернса—Сайра (миопатия, мозжечковые нарушения и сердечная недостаточность), синдром Пирсона (панцитопения, молочно-кислый ацидоз и недостаточность поджелудочной железы), а также хроническая прогрессирующая наружная офтальмоплегия, которая проявляется опущением века.
Нарушением взаимодействия между ядерным и митохондриальным геномами объясняют синдром истощения мтДНК, а также синдром множественных делений мтДНК. Оба эти состояния наследуются как аутосомно-доминантные признаки, поэтому причиной, вероятно, являются мутации ядерных генов.
Болезни дыхательной цепи митохондрий, обусловленные мутациями ядерных генов, можно объединить в две группы — митохондриальные миопатии и митохондриальные энцефаломиопатии. Эти заболевания наследуются как менделевские признаки, но обусловлены недостаточностью ферментов, входящих в один из комплексов дыхательной цепи митохондрий.
Геномный импринтинг
К настоящему времени известны три класса исключений из менделевского правила идентичности гибридов в 1-м поколении. Первое исключение известно давно, и оно связано с Х-сцепленным наследованием.
Второе, только что рассмотренное, касается признаков, определяемых генами мтДНК, которые обладают так называемым материнским наследованием. В основе этих двух классов отклонений от менделевского наследования лежат различия в генетическом вкладе родителей в генотип потомства. При Х-сцепленном наследовании потомство может получить от матери только хромосому X, в то время как от отца хромосому либо X, либо Y. При митохондриальном наследовании зигота, образующаяся в результате слияния половых клеток, получает митохондрии и содержащуюся в них мтДНК только через яйцеклетку.
Недавно генетики и эмбриологи описали третье исключение — геномный импринтинг, когда оба родителя передают потомкам совершенно идентичные гены, но эти гены несут специфический отпечаток пола родителей, отцовские и материнские гены активированы или супрессированы (подавлены, блокированы) во время гаметогенеза по-разному. Таким образом, в некоторых случаях важно, от кого из родителей унаследован ген.
Термин «импринтинг» (imprint — «отпечаток») впервые предложил в 1960 г. Кроуз из Колумбийского университета США.
Геномный импринтинг занимает особое место среди специфических механизмов регуляции активности генов на ранних стадиях развития, приводя к различиям в экспрессии гомологичных материнских и отцовских аллелей. Последующие генетические модификации могут привести к тому, что изменения в экспрессии генов будут стабильно передаваться в процессе развития клеточных поколений. Геномный импринтинг, например, может изменять дозу генов, контролирующих рост эмбриона, клеточную пролиферацию и дифференцировку.
Примером импринтинга целого генома у человека является истинный пузырный занос, который возникает при оплодотворении яйцеклетки, лишенной материнских хромосом, двумя сперматозоидами. Несмотря на наличие полноценного диплоидного набора, ранний эмбриогенез таких зигот протекает аномально: ткани собственно эмбриона вообще не формируются. В случае двойного набора материнских хромосом развивается тератома — эмбриональная опухоль. Только материнский или только отцовский геномы не в состоянии обеспечить нормальное развитие эмбриона.
На организменном уровне эффект импринтинга обнаружен в связи с наличием в хромосомном наборе фрагментов или целых хромосом одного (материнского или отцовского) происхождения — так называемая однородительская дисомия (ОРД), а именно наблюдается качественный, а не количественный хромосомный дисбаланс.
В последние годы интенсивно исследуется эффект геномного импринтинга в связи с различной патологией у человека. Примеров заболеваний, в основе которых лежит расстройство функции импринтированных участков генома, довольно много, поэтому можно говорить об особом классе заболеваний человека — «болезнях импринтинга», которых насчитывается уже более 30.
Наиболее убедительные данные получены при синдроме Прадера—Вилли (СПВ) и синдроме Энжельмена (СЭ), которые, имея существенно разные клинические проявления, в своей основе имеют сходные молекулярно-цитогенетические изменения.
Достаточно хорошо изучен в плане импринтинга также синдром Беквита—Видемана (СБВ), имеющий следующие основные признаки: макросомию, макроглоссию, пупочную грыжу, повышенную предрасположенность к опухолям.
Связь геномного импринтинга с другой наследственной патологией человека на уровне хромосом или отдельных генов также отчетливо прослеживается и в настоящее время широко изучается. Так, например, при хорее Гентингтона и спинномозжечковой атаксии заболевание возникает раньше и протекает тяжелее, если унаследованные гены имеют отцовское происхождение. При нейрофиброматозе, миотонической дистрофии, наоборот, заболевание имеет более раннее начало и тяжелое течение при унаследовании мутантных генов от матери. Не вызывает сомнения причастность геномного импринтинга к этиологии опухолевого роста.
В последние годы с помощью молекулярно-генетических методов феномен геномного импринтинга наблюдают и при мультифакториальных заболеваниях. Например, четко выраженный отцовский импринтинг обнаружен при атопическом дерматите, материнский — при бронхиальной астме и атопии у детей. При инсулинзависимом сахарном диабете выявлена более высокая вероятность отцовского импринтинга.
ГЕННАЯ ИНЖЕНЕРИЯ
Выше были описаны методы молекулярной генетики, которые применяют для идентификации генов менделирующих наследственных болезней человека, такие методики входят в состав международной программы «Геном человека». Ниже будут рассмотрены основные положения генетической инженерии и сущность проекта «Геном человека».
В феврале 2001 г. одновременно в двух журналах, «Nature» и «Science», были представлены результаты чернового проекта всего генома человека, полученные независимо друг от друга международным консорциумом проект«Геномчеловека»и частной компанией «Celera», для которой проект генома человека является коммерческим предприятием. Эти публикации, несмотря на незавершенность проекта, являются значительным достижением всей биологической науки и медицины.
Технология рекомбинантных ДНК
Действительно, к моменту объявления о начале программы «Геном человека» сформировалось целое направление в молекулярной генетике, которое получило название «генетическая инженерия», или «технология рекомбинантных ДНК». Последняя может быть разделена на две большие области: методы клонирования ДНК и методы анализа ДНК, прежде всего определения последовательности нуклеотидов в молекуле ДНК.
Клонирование ДНК
Клонирование ДНК in vivo (в живом организме) включает 6 этапов:
1) получение фрагментов ДНК, в том числе генов или их частей с помощью ферментов рестрикции;
2) рекомбинация фрагментов;
3) вставка фрагмента ДНК в вектор;
4) трансформация с помощью вектора организма хозяина;
5) скрининг на рекомбинантный вектор;
6) отбор интересующих исследователя клонов.
Понятие рестрикционных ферментов
В каждой хромосоме человека имеется только одна непрерывная нить ДНК. Она сложно упакована для того, чтобы поместиться в хромосоме. Манипулировать с молекулой ДНК такой длины практически невозможно. Поэтому открытие в 70-х гг. XX в. особых бактериальных ферментов, разрезающих ДНК на отдельные фрагменты, было очень актуальным.
Ферменты были названы рестриктазами или эндонуклеазами. У бактерий эти ферменты служат для защиты от проникновения в клетку чужеродной ДНК.
Рекомбинация фрагментов ДНК
Рестриктазы разрезают обе нити ДНК, которые в результате образуют либо тупые, либо липкие концы. ДНК одного организма разрезается определенной рестриктазой в строго определенных местах, поэтому такая ДНК после рестрикции (которую также называют перевариванием) всегда будет давать один и тот же набор фрагментов.
Если использовать один вид рестриктазы для разрезания ДНК из разных организмов, то набор фрагментов окажется различным, но последовательность нуклеотидов в местах разрезания будет у всех фрагментов одной и той же и, следовательно, комплементарной друг другу при образовании у фрагментов липких концов. Последние называют липкими, поскольку из-за комплементарности они могут соединяться с другими фрагментами, образованными той же самой рестриктазой или другой рестриктазой, образующей такие же концы. Объединение фрагментов, обладающих липкими комплементарными концами, ускоряется и стабилизируется специальным ферментом, который называют лигазой. Таким образом, если одной рестриктазой разрезать ДНК двух разных видов и смешать фрагменты, то может образоваться совершенно новая, не существующая в природных условиях молекула рекомбинантной ДНК.
Для того чтобы интересующий исследователя фрагмент ДНК можно было исследовать, его необходимо размножить. Это можно сделать двумя разными методами, переместив его в клетку хозяина или размножив его in vitro (в пробирке).
Внедрение фрагментов ДНК в клетку хозяина с помощью векторов
Для перемещения фрагмента ДНК в клетку хозяина обычно используют специальные конструкции, которые называют векторами. Наиболее часто в качестве векторов применяют бактериальные вещества, бактериофаги, бактериальные и дрожжевые искусственные хромосомы. Недавно было предложено использовать в качестве векторов искусственные хромосомы человека.
Создание геномных библиотек
Рестрикция геномной ДНК на фрагменты и клонирование фрагментов с помощью различных векторов создали основу формирования геномных библиотек. Для этого геномная ДНК разрезается или, как говорят, переваривается определенной рестриктазой, а образующиеся фрагменты клонируются с помощью различных векторов, для чего используют методы рекомбинантной ДНК.
Геномная библиотека должна содержать не только гены, но и всю некодирующую ДНК, расположенную между генами. Поскольку переваривание рестриктазой производят неполное, так, что образуются фрагменты ДНК с частично перекрывающимися последовательностями нуклеотидов. Это облегчает последующее восстановление картины расположения фрагментов в нативной ДНК (ДНК в живом организме). Кроме геномных библиотек, существуют библиотеки кДНК.
Клонирование последовательностей ДНК с помощью полимеразной цепной реакции (ПЦР)
Кроме описанного способа клонирования последовательностей ДНК in vivo, существует также способ клонирования in vitro, который получил название полимеразной цепной реакции (ПЦР).
Обязательным условием для проведения ПЦР является знание последовательности нуклеотидов, определяющих клонируемую последовательность. Для проведения ПЦР необходимо предварительно синтезировать пару так называемых праймеров, которые представляют собой короткие последовательности нуклеотидов, комплементарных последовательностям размножаемого фрагмента ДНК.
После разделения на две нити изучаемого фрагмента ДНК в реакционную смесь добавляют вещества, которые комплементарно связываются с соответствующими участками этих нитей. Затем следует разделение вновь образованных ДНК цепей с помощью температурной обработки. К вновь образованным нитям фрагмента ДНК снова достраивают комплементарные цепи с помощью фермента ДНК-полимеразы.
Так может повторяться до бесконечности или до исчерпания свободных нуклеотидов в реакционной смеси, но обычно 20—30 циклов хватает, чтобы получить достаточное количество ДНК изучаемого фрагмента для любых последующих манипуляций с этим фрагментом.
Обновлено: 2019-07-09 23:44:45
- Гиперлизинемия (стойкая) II типа
- Сахарный диабет лечение народными средствами
- Амилаза
- Наследственные заболевания
- Иммунологические методы
- Диагностика моногенных нарушений
Источник: medn.ru
Генетики превратили ДНК живых клеток в «перезаписываемый CD-диск»
Китайские ученые представили новый метод кодирования данных в ДНК «in vivo». Технология обеспечивает высокую эффективность перезаписи данных.
Читайте «Хайтек» в
Ученые из Университета Цинхуа, Чжэцзянского университета и Китайской академии наук разработали алгоритм кодирования информации в ДНК «in vivo» (внутри живой клетки) и механизм редактирования записанных данных. Система из двух плазмид подходит для хранения, чтения и перезаписи различных типов информации, включая текст, кодовые книги и изображения.
В своей работе исследователи использовали систему, состоящую из двух плазмид. Это небольшие молекулы ДНК, обособленные от хромосом и способные к автономной репликации. Ученые ввели две такие молекулы, отредактированные с помощью технологии CRISPR, в клетки кишечной палочки (Escherichia coli).
Чтобы обеспечить эффективность записи, хранения и надежность перезаписи информации, генетики использовали различные CRISPR-ассоциированные белки (Cas) и рекомбиназу. Они использовали молекулы РНК CRISPR, соответствующие нужной информации, чтобы найти и перезаписать нужную информацию. При этом рекомбиназа реконструировала ДНК, чтобы подготовить ее для кодирования новой информации.
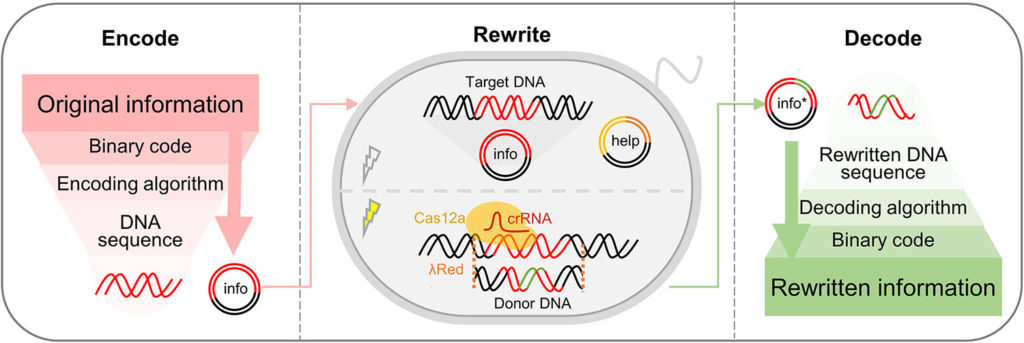
Эксперименты показали, что с помощью этой технологии оптимизированную последовательность CRISPR РНК легко адаптировать для записи изменения любой сложной информации. Генетики смогли достичь надежности перезаписи в 94%. При этом переписанная информация стабильно сохранялась и усиливалась на протяжении сотен поколений бактерии.
Технология хранения данных ДНК имеет два режима, объясняют авторы работы: «режим жесткого диска in vitro» и «режим компакт-диска in vivo». Преимущество хранения информации в живых клетках — недорогая и надежная репликация. Благодаря этому этот режим можно использовать для быстрого и недорогого распространения копий данных.
Исследователи полагают, что плазмидная система может служить универсальной платформой для перезаписи информации на основе ДНК «in vivo». Ее можно использовать в качестве новой стратегии обработки информации и целенаправленной перезаписи больших и сложных данных на молекулярном уровне. При этом тот же подход можно применять и к живому хозяину с более крупным геномом, например, к дрожжам, чтобы хранить больший объем данных.
Читать далее:
Источник: hightech.fm
Вопрос 128. Методы клонирования ДНК.
Молекулярное клонирование — способ получения миллионов копий определенной последовательности ДНК или гена внутри бактериальной клетки. Сначала фрагмент ДНК помещают в вектор для клонирования. В качестве векторов чаще всего используют небольшие кольцевые молекулы ДНК, называемые плазмидами, или бактериальные вирусы, называемые фагами.
Векторы содержат генетическую информацию, что позволяет бактериальной клетке реплицировать последовательность ДНК. После внедрения фрагмента ДНК плазмиду или фаг вводят в бактериальную клетку.
Размножающиеся в культуре бактерии реплицируют вектор, содержащий требуемую последовательность ДНК, в количестве сотен копий на клетку, позволяя получить множество идентичных копий исходной последовательности ДНК. Затем векторы извлекают из культуры бактериальных клеток с помощью тех же рестрикционных ферментов, которые были использованы для включения фрагмента ДНК в вектор. Каждый рестрикционный фермент распознает специфическую последовательность нуклеотидов. Эти области распознавания расположены вдоль молекулы ДНК любого организма случайным образом и состоят из короткого симметричного мотива, называемого палиндромом, который одинаково прочитывается в противоположных направлениях на обеих цепях двойной спирали ДНК.
Полный ответ:
После того, как ДНК сшита в пробирке, ее необходимо размножить(клонировать).
Существует два подхода к клонированию ДНК. Первый подход предполагает использование бактериальных или дрожжевых клеток для размножения введенной в них чужеродной ДНК. Второй способ представляет собой амплификацию ДНК in vitro.
Клонирование ДНК in vivo. Используя микроорганизмы, можно создавать два типа библиотек ДНК: геномную и клоновую (кДНК).
Геномная библиотека (банк генов, клонотека)– это коллекция клонов ДНК, включающая все фрагменты, входящие в геном данного вида. Т. е. банк генов еще можно назвать набором клонированных фрагментов генома. Если геном какого-либо организма разрезать, вставить в плазмидные или вирусные вектора и ввести в клетку, то в таком виде его можно сохранить.
При разрезании плазмидной или фаговой ДНК вероятность выпадения целых и неизмененных кусков генома довольно высока. Такой способ получения геномной библиотеки получил название «метод дробовика», так как геном в данном случае представлен отдельными фрагментами. Библиотека кДНК.
Создание кДНК начинается с синтеза на матрице РНК с помощью обратной транскриптазы комплементарной нити ДНК. Затем создают щелочные условия, разрушают цепь РНК на нуклеотиды, после чего с помощью ДНК-полимеразы синтезируют комплементарную цепь ДНК. При этом образуется фрагмент ДНК с тупыми концами. Такую ДНК встраивают в плазмиды и вводят в клетки бактерий. При амплификации плазмиды образуется клон комплементарной копии ДНК (кДНК).
Полимеразная цепная реакция (ПЦР) –ферментативная реакция, осуществляемая in vitro с помощью термостабильной ДНК-полимеразы на матрице ДНК с использованием олигонуклеотидных ДНК-затравок (праймеров), комплементарных нуклеотидным последовательностям противоположных цепей ДНК на границах амплифицируемого участка. ПЦР представляет собой серию из 3-х циклически повторяющихся реакций (обычно в сумме осуществляют 20—30 циклов): денатурация ДНК, отжиг ДНК-затравок с матрицей и синтез ДНК с помощью ДНК-полимеразы с каждой из затравок навстречу друг другу с использованием противоположных цепей ДНК в качестве матриц; по завершении каждого цикла количество синтезированного продукта удваивается и происходит увеличение количества анализируемой ДНК в геометрической прогрессии, что позволяет в миллионы раз увеличивать количество изучаемого фрагмента ДНК в пробе.
Вопрос №129
Клонирование генов.
Краткий ответ:
Клонирование генов–это процедура, включающая выделение и амплификацию отдельных генов в реципиентных клетках, про- или эукариотических. С информационной РНК, выделяемой из однотипных клеток организма, снимают ДНК-копии (кДНК), которые затем вводят в реципиентные клетки, и амплифицируют. Клонирование ДНК in vivo включает 4 этапов:
1) получение фрагментов ДНК, в том числе генов или их частей с помощью ферментов рестрикции;
2) рекомбинация фрагментов,
3) вставка фрагмента ДНК в вектор;
4) трансформация с помощью вектора организма хозяина;
5) скрининг на рекомбинантный вектор
6) отбор интересующих исследователя клонов.
Реципиентные клетки – клетки, выбранные для клонирования гена, могут быть как про-, так и эукариотическими.
мРНК выделяют из клеток или тканей, в которых экспрессируется искомый ген.
Синтез ДНК — копийосуществляется ферментом РНК-зависимой ДНК-полимеразой. Чтобы этот фермент начал работать, требуется короткая одноцепочечная ДНК-затравка; для этой цели, как правило, используют oligo(dT). Затравочная ДНК самопроизвольно образует двухцепочечный комплекс с отрезком poly(dA).
Деполимеризацию исходной РНК-цепочки осуществляют путем щелочного гидролиза. Цепи ДНКустойчивы к обработке щелочью, а РНК полностью деполимеризуется. Получившаяся в результате ДНК является одноцепочечной.
Двухцепочечную (дц) кДНКполучают путем достраивания оц-кДНК до двухцепочечной формы, выполняемого ферментом ДНК-полимеразой I. Такую кДНК можно встраивать в вектор.
Существует два основных типа векторов: бактериальные плазмиды и бактериофаги.
Плазмиды— это встречающиеся в клетках внехромосомные элементы, представляющие собой замкнутые кольцевые молекулы дц-ДНК. Чтобы включить кДНК в плазмиду, замкнутое кольцо плазмиды надо «разомкнуть». Для этого плазмиды подвергают воздействию рестриктаз.
Рестриктаза- разрезает дц-ДНК по определенным нуклеотидным последовательностям, называемым участками рестрикции.
Сшивание (лигирование)— процедура, в ходе которой чужеродная ДНК встраивается между (или сшивается с двумя концами плазмидной ДНК с помощью фермента, называемого ДНК-лигазой.
Трансформацияпроисходит после того, как рекомбинантную плазмиду добавляют к бактерии-реципиенту: плазмида проникает внутрь бактерии и включается в ее жизненный цикл.
Скрининг («просеивание»)— это процедура, необходимость применения которой обусловлена тем, что в исходном препарате кДНК представлено много разных мРНК и лишь часть плазмид несет нужный нам ген.
Амплификация осуществляется благодаря тому, что в одной бактериальной клетке может синтезироваться много копий интересующей нас плазмиды, а также за счет получения большого количества клеток с такими плазмидами. После выделения и очистки плазмиды обрабатывают соответствующей рестриктазой, которая вырезает встроенные в них копии искомого гена. Амплифицированный таким образом ген можно использовать для дальнейших экспериментов в области генной инженерии.
Вопрос №130
Генетически модифицированные организмы.
Генетически модифицированный организм (ГМО) — организм, генотип которого был искусственно изменён при помощи методов генной инженерии (растения, животные и микроорганизмы).
Генная инженерия — совокупность приёмов, методов и технологий получения рекомбинантных РНК и ДНК, выделения генов из организма, осуществления манипуляций с генами и введения их в другие организмы. В отличие от традиционной селекции, в ходе которой генотип подвергается изменениям лишь косвенно, генная инженерия позволяет непосредственно вмешиваться в генетический аппарат, применяя технику молекулярного клонирования.
Основным видом генетической модификации в настоящее время является использование трансгенов для создания трансгенных организмов.
Трансген — фрагмент ДНК, переносимый при помощи генно-инженерных манипуляций в геном определённого организма с целью модификации его свойств. Трансген может быть выделен из биологического объекта или синтезирован искусственно.
Трансге́нный органи́зм — живой организм, в геном которого искусственно введен ген, который не может быть приобретен при естественном скрещивании.
Основные этапы создания ГМО:
1. Получение изолированного гена.
2. Введение гена в вектор для переноса в организм.
Вектор- молекула нуклеиновой кислоты, чаще всего ДНК, используемая в генетической инженерии для передачи генетического материала другой клетке. Чтобы встроить ген в вектор, используют ферменты — рестриктазы и лигазы. С помощью рестриктаз ген и вектор можно разрезать на кусочки. С помощью лигаз такие кусочки можно «склеивать», соединять в иной комбинации, конструируя новый ген или заключая его в вектор.
3. Перенос вектора с геном в модифицируемый организм.
4. Преобразование клеток организма.
5. Отбор генетически модифицированных организмов и устранение тех, которые не были успешно модифицированы.
Применение:
В медицине: при помощи трансгенной бактерии производится человеческий инсулин.
В фармацевтической промышленности: выпускается большое количество лекарственных средств на основе рекомбинантных белков человека
В сельском хозяйстве: для создания новых сортов растений, устойчивых к неблагоприятным условиям среды и вредителям, повышение урожайности.
А также: разрабатываются генетически модифицированные бактерии, способные производить экологически чистое топливо.
Генетически модифицированная пища- это продукты питания, полученные из генетически модифицированных организмов (ГМО). Большинство культивируемых генно-модифицированных организмов обладают устойчивостью к возбудителям болезней (к вирусам и грибам), насекомым-вредителям или к гербицидам.
131. Структура генома.
Геном — вся совокупность молекул ДНК клетки (в случае ряда вирусов говорят о геномной РНК).
Существует ядерный геном, митохондриальный геном и геном пластид. Мы будем рассматривать только ядерный геном. Соматические клетки содержат диплоидный (2n) геном, половые — гаплоидный (n).
Размер генома
| Объект | Размер гаплоидного генома в парах нуклеотидов |
| Микоплазмы | 104-106 |
| Эубактерии (E.coli) | 105-107 |
| Грибы | (2-5)х107 |
| Водоросли | (5-7)х107 |
| Черви | ~108 |
| Моллюски | 5х108-5х109 |
| Насекомые | 108-5х109 |
| Ракообразные | ~ 109 |
| Иглокожие | 2х108-2х109 |
| Рыбы | 3х108-1010 |
| Амфибии | 7х108-7х1010 |
| Рептилии | (2-3)х109 |
| Птицы | 109 |
| Млекопитающие | 3х109 |
| Цветковые растения | 2х108-1011 |
Геном — вся совокупность молекул ДНК клетки (в случае ряда вирусов говорят о геномной РНК).
Существует ядерный геном, митохондриальный геном и геном пластид. Соматические клетки содержат диплоидный (2n) геном, половые — гаплоидный (n).
Прямой корреляции между количеством ДНК и эволюционной продвинутостью организма нет.
Так, например, у малярийного плазмодия 0.06 пг ДНК в ядре, а у амебы 490 пг. Большое количество ДНК не обязательно приносит качественно новую информацию. Амеба пошла на увеличение количества ДНК для увеличения размеров ядра и самой клетки. Генов у нее меньше, чем у плазмодия, но они копированы много раз.
У малярийного плазмодия генов больше, чем у амебы, а ДНК меньше для максимальной компактности. Малые размеры ядра и самого одноклеточного организма позволяют ему быть внутриклеточным паразитом.
«Избыточность» эукариотического генома
На ~ 10 6 пар нуклеотидов у бактерий приходится ~5 тыс. генов. На ~10 9 пар нуклеотидов у млекопитающих ~50 тыс. генов.
Минусы «избыточной» ДНК:
— увеличение времени синтеза ДНК;
— cложнее организовывать удвоение ДНК;
— высокая энергоемкость — на 1 нуклеотид для включения в цепь ДНК нужно затратить ~60 молекул АТФ.
Неопределенное следствие:
— благодаря зависимости размера ядра от количества ДНК происходит увеличение размеров клетки.
Плюсы «избыточной» ДНК:
— возникает возможность создания сложного регуляторного аппарата, позволяющего поднять организм на более высокий эволюционный уровень.
Причины избыточности:
1. Большой размер генов (за счет наличия интронов).
2. Присутствие повторенных последовательностей. Повторяются и гены, и некодирующие участки. У эукариот некоторые последовательности повторены сотни и тысячи раз.
3. Наличие большого числа некодирующих последовательностей, часть из которых выполняет регуляторную функцию при транскрипции, а часть — необходима для компактизации генома.
Источник: lektsia.info
