Современный взгляд на оплодотворение и имплантацию. Достижения ЭКО
Особенности оплодотворения:
• Естественный процесс оплодотворения in vivo еще не изучен до конца. Тем не менее последние достижения в области вспомогательных репродуктивных технологий (ВРТ) приблизили нас к полному пониманию проблемы.
• Половые клетки млекопитающих перемещаются по мужскому и женскому репродуктивным трактам до тех пор, пока не сойдутся в ампуле фаллопиевой трубы. Последующее взаимодействие двух гамет проходит в несколько этапов, завершающихся образованием зиготы. К этим этапам относятся связывание сперматозоида с оболочкой яйцеклетки и ее пенетрация, активация ооцита, формирование мужского и женского пронуклеусов, инициация клеточного деления и раннего развития.
• Клеточные и молекулярные события, происходящие во время ЭКО и интрацитоплазматической инъекции сперматозоида (ИКСИ), во многих аспектах отличаются от происходящих in vivo. Несмотря на это, в результате ЭКО и интрацитоплазматической инъекции сперматозоида (ИКСИ) получаются нормальные эмбрионы, дающие начало нормальной беременности, заканчивающейся рождением здоровых детей.
ВЛИЯНИЕ ЭКСТРАКТА ТИМЬЯНА МАРШАЛЛА НА ПРОЦЕССЫ ЛИПОПЕРОКСИДАЦИИ В ОПЫТЕ IN VIVO НА ФОНЕ ПЕРЕВИТОГО..
• Полное отсутствие оплодотворения — худший исход программ ЭКО. О механизмах нарушения оплодотворения в программах ЭКО или ИКСИ известно мало, но их можно разделить на несколько групп:
— нарушения капацитации сперматозоидов и акросомальной реакции;
— нарушения прикрепления, связывания и проникновения в блестящую оболочку (БО);
— нарушения передачи сигнала, активации ооцита, образования пронуклеусов, аппозиции;
— остановка первого митотического деления эмбриона в стадии метафазной пластинки.
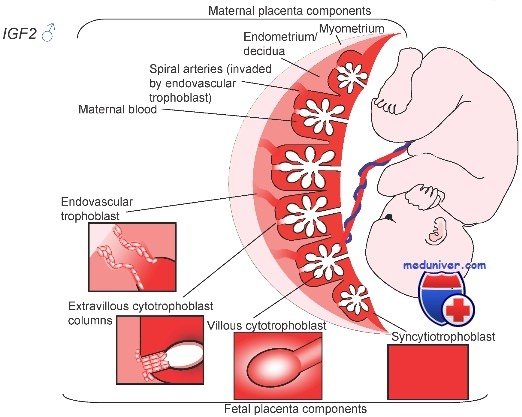
Особенности имплантации:
• Ранний эмбрион остается в ампуле маточной трубы в течение приблизительно 80 ч после овуляции, проходит через перешеек приблизительно за 10 ч, после чего попадает в матку в стадии 8 или 16 клеток. Превращение его в бластоцисту происходит в условиях свободной флотации в полости эндометрия через 90-150 ч после зачатия.
• Имплантация начинается с хэтчинга («вылупления») из блестящей оболочки (БО) через 2-3 дня после транспорта морулы в полость матки.
• Эндометрий обладает рецептивностью к бластоцисте в течение очень короткого и строго определенного периода времени. Этот феномен — результат комплексного действия половых гормонов (особенно прогестерона), эмбриональных регуляторных механизмов, запускающих эмбрионально-маточное взаимодействие, а также активности некоторых цитокинов и факторов роста.
• Вступив в контакт с эндометрием, бластоциста окутывается наружным слоем синцитиотрофобласта (многоядерной массы без различимых межклеточных границ) и внутренним слоем цитотрофобласта, состоящего из отдельных клеток. Синцитиотрофобласт эррозирует эндометрий, в результате чего происходит имплантация бластоцисты. Этот процесс опосредован цитокинами и вовлекает молекулы адгезии, главным образом интегрины.
How Ex-Vivo Gene Therapy Works | Boston Children’s Hospital
• Неспособность эмбриона к полноценной имплантации в эндометрий — распространенная причина привычного невынашивания беременности после оплодотворения in vivo и in vitro.
Видео физиология оплодотворения
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Развитие плаценты. Ангиогенез и васкуляризация
- Современный взгляд на оплодотворение и имплантацию. Достижения ЭКО
- Гипоталамо-гипофизарно-яичниковая система. Возрастные особенности
- Механизмы начала полового созревания. Значение жировой ткани
- Стадии полового созревания. Возрастные периоды
- Оценка полового развития девочек. Сбор анамнеза и осмотр
- Преждевременное половое развитие ребенка. Когда начать беспокоиться?
- Центральное преждевременное поволое развитие детей. Причины и диагностика
- Лечение центрального преждевременного полового созревания детей. Задачи и лекарства
- Нецентральное преждевременное половое созревания девочек. Причины и лечение
Источник: meduniver.com
Репликация ДНК in vivo
В живой клетке репликация ДНК представляет собой весьма сложный процесс. В частности, в нем участвует несколько ДНК-полимераз, заметно различающихся по свойствам и функциям. Кроме ДНК-полимераз в нем участвует еще около двух десятков белков. Репликация начинается в участках ДНК, имеющих определенную нуклеотидную последовательность и называемых ориджинами (англ. origin — начало). Этот участок узнают и присоединяются к нему ДНК-топоизомераза и ДНК-хеликаза.
Репликация ДНК.
ДНК-топоизомераза разрывает одну из цепей ДНК (гидролизует одну 3′,5′-фосфодиэфирную связь), и тем самым делает возможным раскручивание двойной спирали. Это временные разрывы, чуть позднее они ликвидируются: та же ДНК-топоизомераза восстанавливает 3′,5′-фосфодиэфирную связь в месте разрыва.
Для раскручивания, кроме образования разрывов, еще необходимо разделить цепи, т. е. разорвать водородные связи между комплементарными нуклеотидами. Это делает ДНК-хеликаза. Разделение цепей — процесс не самопроизвольный, на разделение каждой пары нуклеотидов расходуется одна молекула АТФ. Обратный процесс — соединение цепей — происходит самопроизвольно, но во время репликации он заторможен специальными белками SSB (англ. single strand binding— соединяющиеся с одинарными цепями).ДНК-топоизомераза ликвидирует разрывы цепей еще до того, как произойдет их разделение с участием ДНК-хеликазы и SSB.
Область, где двухцепочечная ДНК граничит с одноцепочечной, называют репликативной вилкой. Репликативная вилка и белки, участвующие в репликации, образуют репликативный комплекс.
На каждой из одноцепочечных цепей репликативной вилки происходит синтез новых цепей, но не одинаково. Различия связаны с тем, что матричные цепи расположены антипараллельно, а синтез новых цепей возможен только с их З’-конца. Рассмотрим сначала синтез той цепи, которую называют лидирующей (см. рис. 4.5).
Прежде всего, в месте расхождения цепей образуется затравка (прай-мер), которая представляет собой короткий (около 10 нуклеотидов) полирибонук-леотид (РНК, не полидезоксирибонуклеотид), комплементарный матричной цепи. Синтез затравки осуществляет фермент праймаза (ДНК-полимераза а). Затем З’-конец затравки начинает расти уже за счет присоединения дезоксирибонуклео-тидных остатков при участии ДНК-полимеразы 5. Удлинение ведущей цепи происходит непрерывно по мере перемещения репликативного комплекса вдоль матричной цепи ДНК.
Другая растущая цепь (отстающая) образуется прерывисто. В этом случае З’-конец матричной цепи ориентирован не в сторону движения репликативной вилки, а в противоположную сторону.
Поэтому синтез затравки и последующее наращивание ее З’-конца ДНК-полимеразой е (другая ДНК-полимераза, не та, которая действует в лидирующей цепи) начинаются не в точке расхождения цепей, а тогда, когда освободится участок матрицы длиной около 200 нуклеотидов. При этом образуются короткие цепи ДНК, содержащие праймер. По имени первооткрывателя их называют фрагментами Оказаки.
Затем при участии ДНК-по-лимеразы (3 (еще одна ДНК-полимераза!) удаляется РНК-праймер, и на его месте образуется дезоксирибонуклеотидная последовательность. В результате получаются фрагменты цепи длиной около 200 нуклеотидов (у эукариот), не соединенные между собой. Соединение этих фрагментов 3′,5′-фосфодиэфирной связью осуществляет еще один фермент репликативного комплекса — ДНК-лигаза.
Источник: biohimija.ru
Методы генетического конструирования организмов in vivo

Конъюгация бактерий состоит в переходе генетического материала (ДНК) из клетки-донора («мужской») в клетку-реципиент («женскую») при контакте клеток между собой.
Мужская клетка содержит F-фактор, или половой фактор, который контролирует синтез так называемых половых пилей, или F-пилей. Клетки, не содержащие F-фактора, являются женскими; при получении F-фактора они превращаются в «мужские» и сами становятся донорами. F-фактор располагается в цитоплазме в виде кольцевой двунитчатой молекулы ДНК, т. е. является плазмидой.
Переносимая ДНК взаимодействует с ДНК реципиента — происходит гомологичная рекомбинация. Прерывая процесс конъюгации бактерий, можно определять последовательность расположения генов в хромосоме. Иногда F-фактор может при выходе из хромосомы захватывать небольшую ее часть, образуя так называемый замещенный фактор — F’. При конъюгации происходит только частичный перенос генетического материала, поэтому ее не следует отождествлять полностью с половым процессом у других организмов.
Трансдукция — передача ДНК от бактерии-донора к бактерии-реципиенту при участии бактериофага. Различают неспецифическую (общую) трансдукцию, при которой возможен перенос любого фрагмента ДНК донора, и специфическую — перенос определенного фрагмента ДНК донора только в определенные участки ДНК реципиента.
Неспецифическая трансдукция обусловлена включением ДНК донора в головку фага дополнительно к геному фага или вместо генома фага (дефектные фаги). Специфическая трансдукция обусловлена замещением некоторых генов фага генами хромосомы клетки-донора. Фаговая ДНК, несущая фрагменты хромосомы клетки-донора, включается в строго определенные участки хромосомы клетки-реципиента. Таким образом, привносятся новые гены и ДНК фага в виде профага репродуцируется вместе с хромосомой, т.е. этот процесс сопровождается лизоге-нией. Если фрагмент ДНК, переносимый фагом, не вступает в рекомбинацию с хромосомой реципиента и не реплицируется, но с него считывается информация о синтезе соответствующего продукта, такая трансдукция называется абортивной.
Трансформация заключается в том, что ДНК, выделенная из бактерий в свободной растворимой форме, передается бактерии-реципиенту. При трансформации рекомбинация происходит, если ДНК бактерий родственны друг другу. В этом случае возможен обмен гомологичных участков собственной и проникшей извне ДНК. Впервые явление трансформации описал Ф. Гриффите (1928).
Он вводил мышам живой невирулентный бескапсульный R-штамм пневмококка и одновременно убитый вирулентный капсульный S-штамм пневмококка. Из крови погибших мышей был выделен вирулентный пневмококк, имеющий капсулу убитого S-штамма пневмококка. Таким образом, убитый S-штамм пневмококка передал наследственную способность капсулообразования R-штамму пневмококка.
Путем трансформации могут быть перенесены различные признаки: капсулообразование, устойчивость к антибиотикам, синтез ферментов.
Субстраты для культивирования биообъектов. Состав и методы оптимизации питательных сред.
Самым главным направлением биотехнологии (основной задачей) является всемерная интенсификация производственных процессов, что достигается, с одной стороны, внедрением новых высокопродуктивных биологических объектов (продуцентов), а также широким применением эффективных технологических приемов (технологических режимов).
Цель достигается подбором подходящего сырья (субстрата для выращивания продуцента), разработкой наилучшей конструкции биореактора (ферментора), оптимизацией условий культивирования продуцента, обеспечением эффективного контроля за самим технологическим процессом, а также усовершенствованием способов выделения и очистки целевого продукта.
Питательные среды для выращивания объектов биотехнологии, т. е. продуцентов тех или иных соединений, могут быть неопределенного состава и включать различные биогенные добавки (растительные, животные или микробные) – мясной экстракт, кукурузную муку, морские водоросли и т. п. Применяются также среды из чистых химических соединений определенного состава, так называемые синтетические.
Компонентный состав сред определяется питательными потребностями продуцента. Во многих процессах используют в качестве объектов организмы, ранее называвшиеся гетеротрофами, которые в настоящее время подразделяются на: органо-автотрофы (употребляющие органические вещества как источники энергии), литогетеротрофы (использующие органические вещества как источники углерода) и органогетеротрофы (для которых органические вещества служат и источниками энергии, и источниками углерода).
Питательные среды призваны обеспечивать жизнеспособность, рост и развитие соответствующих продуцентов, а также синтез целевого продукта с максимальной эффективностью. Требования к питательным средам, используемым в биотехнологии, ничем не отличаются от требований, предъявляемым к питательным средам, применяемым в микробиологии для культивирования тех или иных микроорганизмов.
Для приготовления питательных сред в биотехнологии используются разнообразные субстраты, которые должны удовлетворять определенным критериям.
Субстрат представляет собой сырье для получения целевого продукта и должен быть недефицитным, дешевым, по возможности легко доступным.
Растительная биомасса и (в меньшей степени) биомасса животных организмов представляют собой достаточно хорошо утилизируемые источники углерода для биотехнологических целей. На основе этих источников основано давно существующее производство алкоголя из зерна и сыра из молока.
Дата добавления: 2020-04-08 ; просмотров: 609 ; Мы поможем в написании вашей работы!
Поделиться с друзьями:
Источник: studopedia.net
