Изначально культуры клеток приспособили под выращивание и репродукцию в таких клетках вирусов. Как известно, вирусы имеют обыкновение размножаться только в живых клетках, поэтому их репродуцируют, как это ни грустно, в живых организмах.
Есть вирусы, которые можно размножать в эмбрионах куриного яйца, но их спектр очень невелик, так что более всего страдают от подобных экспериментов лабораторные мыши. Совершенствование методик культивирования клеток животных позволило использовать их для накопления больших количеств вирусного материала с целью производства из него вакцин.
Сейчас же стало возможным вставить в клетки специфические экзогенно полученные гены и получить их экспрессию, а также подтверждена возможность выращивания в культуре из одиночной клетки целой популяции. Когда такие популяции получают из клетки, выделявшей в окружающую среду антитела, то все молекулы антител в надосадочной жидкости одинаковы. Первое – дает возможность получения трансгенных клеток, тканей или организмов, второе – незаменимо для получения моноклональных антител. Для чего они нужны – постараемся рассмотреть в дальнейших выпусках.
Introducing ZEISS CONVIVO — In Vivo Pathology Suite
Чтобы показать способность клеток животных расти и делиться в культуре, потребовалось овладеть рядом подходов и методик:
1. Методики получения клеток, свободных от экзогенных прокариотов и грибов.
2. Методики разработки среды, в которых рост «вырезанных из ткани» или изолированных клеток не подавляется.
3. Методики наблюдения за клетками в динамике их развития.
4. Методики непрерывного культивирования культур клеток животных in vitro и поддержания их свободными от других биологических агентов.
Идея о том, что клетки тканей животных можно выделить из организма и затем создать условия для роста и воспроизводства их in vitro, возникла на базе концепции, принадлежащей Клоду Бернару. Он предположил, что не только живые организмы способны сохранять постоянство внутренних условий, вне зависимости от изменений в окружающей среде. Клетка вне организма животного тоже будет стремиться поддерживать свои внутренние условия. Если различия между внутренними и внешними условиями будут незначительными, то высока вероятность роста и деления клетки. Такое понимание явления приводит к необходимости разработки сред, способных поддерживать и стимулировать рост клеток вне организма.
Чуть позже, в 1885 году, У. Ру (W. Roux) показал возможность сохранения вне организма живых тканей на практике. Он сохранял в жизнеспособном состоянии оболочку куриного эмбриона в теплом физиологическом растворе. Впоследствии он стал автором, активно публиковавшимся по проблемам эмбриологии in vitro.
Позднее, в 1897 г., Леб (Loeb) поддерживал в жизнеспособном состоянии клетки крови и соединительной ткани в пробирках с сывороткой и плазмой крови. Льюнгрен (1898) показал возможность поддержания эксплантатов кожи человека в жизнеспособном состоянии в кислой среде с сохранением способности к реимплантации. Дополнительные эксперименты были проведены Джолли (1903), наблюдавшим деление клетки в висячей капле, содержащей лейкоциты саламандры, а Биб и Эвинг (1906) подтвердили это при пересадке лимфосаркомной ткани собаки.
Что такое кожа? Строение эпидермиса (видео 2) | Анатомия человека | Биология
Продолжая работы Ру, Росс Харрисон усовершенствовал методику «висячей капли». Он использовал небольшие кусочки ткани, отторгнутые от медуллярного сосуда лягушки к внедренные в ее лимфатический тромб, и выдерживал их в виде капли на нижней стороне покровного стекла, расположенного поверх углубления в предметном стекле. В 1907 г. ему удалось наблюдать с помощью такой «камеры» рост нервных клеток в течение нескольких недель; он установил, что скорость роста этих клеток составляет 20 мкм за 25 мин. В то время как эксперименты Харрисона были направлены на то, чтобы получить ответы на вопросы, относящиеся к физиологии нервных клеток лягушки, методика, которой он пользовался, была применена Барроузом для других клеток тканей теплокровных животных. Этот исследователь в 1910 г. вместо лимфатического тромба использовал тромб плазмы курицы.
В 1913 г. Алексис Каррель применил плазму крови, обогащенную экстрактом эмбриона. Добавка такого экстракта ускоряла рост тканей. Примененная методика обеспечивала значительно большую вероятность успеха, чем та, которую использовали Левис (1911) и Рид (1908 г.).
Рид готовила культуры клеток из костного мозга морской свинки и пыталась выращивать эксплантаты на среде определенного химического состава. Работа Карреля привлекла большое внимание, так как она была опубликована под интригующим названием – культивирование «бессмертных» клеток.
Инкубация клеток сердца куриною эмбриона была начала 17 января 1912 г. Пересев клеток продолжил Эблинг, как он сам заявлял, работая с ними 34 года. Поскольку Каррель был хирургом, весьма сведущим в вопросах асептики, он смог внести существенный вклад в культивирование клеток животных in vitro.
В то же время организация и технические условия проводимых экспериментов были очень громоздкими. Ассистенты Карреля были одеты в длиннополые резиновые халаты темного цвета с капюшонами для полного прикрытия головы. Процедуры были длительными и отягощенными многими деталями.
В результате тех требований, которые выдвигались автором в отношении сложных мер предосторожности для предотвращения контаминации, вокруг данного предмета создалась атмосфера таинственности и исключительности, что скорее тормозило прогресс, чем способствовало ему. Тем не менее, им было достигнуто многое. В частности, даже при отсутствии антибиотиков он добился успеха в пересадке клеток, используя хирургическую технику для отторжения отдельных колоний и переноса их в новые условия роста. Каррель также продемонстрировал своим коллегам научное значение тех наблюдений, которые могут быть сделаны в процессе пересадки клеток.
В ходе проделанных работ был внесен ряд поправок в рецептуру среды культивирования. В частности, Тирод модифицировал раствор Рингера и в дополнение к куриной сыворотке и эмбриональному экстракту стал использовать коагулят фибрина. Для наблюдения за делящимися клетками животных Канти в 1928 г. разработал метод кинофотомикрографии.
В этот же период был разработан дополнительный и очень существенный подход в технике работы с клетками. Имеется в виду применение трипсина для высвобождения клеток из тканевой матрицы, в которой они находятся. Однако эта методика не находила признания до тех пор, пока в 1937 г. Симмс и Стидлман использовали ее для пассирования клеток между культурами плазмы. Эта методика дает возможность успешно применять в культурах индивидуальные клетки, а не ткани.
Впервые клоны клеток в культуре из одиночной клетки были получены Эрлом с сотрудниками в 1948 году. Игл (1955) систематически исследовал пищевые потребности клеток в условиях. До тех пор, пока в 1961 г. Хейфлик и Мурхед не выделили линию диплоидных клеток человека (НДС) WI-38, считалось, что один раз установившаяся клеточная линия имеет неограниченное время жизни.
Относительно линии WI-38 было показано, что период ее существования в культуре ограничивается приблизительно 50 удваиваниями популяции. Перед отмиранием популяции для клеток этой линии характерен феномен старения. Однако при отмирании эти клетки оставались диплоидными и не имели признаков злокачественных изменений.
Клетки, выделенные из раковых опухолей или трансформированные в ходе культивирования, характеризуются «бессмертностью» и коррелируют с гетероплоидностью. Первые суспензионные культуры клеток животных, как правило, основывались на клетках злокачественных тканей. Это – клетки HeLa, выделенные из раковой опухоли шейки матки человека. Перевиваемая линия карциномы шейки матки была выделена еще в 1952 году Джеем с сотрудниками, она используется и в настоящее время во многих лабораториях мира.
Последующий этап в истории культивирования диплоидных клеток человека связан с установлением факта, что они являются генетически стабильными и свободными от всех известных латентных и онкогенных вирусов. Поэтому линии диплоидных клеток человека разрешено применять для получения продуктов, предназначаемых для людей.
Эта догма остается действующей и в настоящее время, хотя новейшие открытия отчетливо показали присутствие в клетках, выделенных из нормальных тканей, потенциальных онкогенов, идентичных тем, которые найдены в таких известных онкогенных вирусах, как вирус саркомы Рауса и вирус саркомы Молони. Раус еще в 1910 году индуцировал опухоль, использовав профильтрованный экстракт куриной опухоли. Эта опухоль была индуцирована РНК-вирусом (вирус саркомы Рауса). Позднее было установлено, что ряд вирусов способен индуцировать возникновение опухолей, такие вирусы были названы онкогенными.
В соответствии с целями и задачами экспериментальной работы можно выделить два направления культивирования животных клеток:
– культуры клеток;
– культуры органов и тканей (органные культуры).
Культуры клеток лишены структурной организации, теряют характерную гистиотипическую архитектуру и связанные с ней биохимические признаки и обычно не достигают равновесного состояния при отсутствии специальных условий. Клетки в культурах размножаются, что обеспечивает получение большой массы клеток, затем их идентифицируют (по фенотипическим признакам, путем выращивания в селективной среде, генотипически), разделяют на идентичные параллели и, если это необходимо, сохраняют. Динамические свойства культивируемых клеток часто трудно контролировать, также трудно реконструировать in vitro некоторые клеточные взаимодействия, наблюдаемые in vivo. В связи с этим некоторые исследователи предпочитают использовать клеточные системы, сохраняющие структурную целостность исходной ткани.
Список типов клеток, которые уже введены в культуру, достаточно велик. Это элементы соединительной ткани человека (фибробласты), скелетные ткани (кость и хрящи), скелетные, сердечные и гладкие мышцы, эпителиальные ткани (печень, легкие, почки и др.), клетки нервной системы, эндокринные клетки (надпочечники, гипофиз, клетки островков Лангерганса), меланоциты и различные опухолевые клетки.
Популяция клеток не всегда гомогенна и обладает фиксированным фенотипом. Некоторые культуры, например, кератиноциты эпидермиса, содержат стволовые клетки, клетки-предшественники и кератинизированные чешуйчатые клетки. В такой культуре происходит постоянное обновление за счет стволовых клеток, пролиферация и созревание клеток-предшественников, а также необратимая дифференцировка, сопровождающаяся «слущиванием» чешуйчатых клеток в культуральную среду.
Какую ткань лучше брать для введения в культуру, взрослую или эмбриональную, нормальную или опухолевую?
Культуры, полученные из эмбриональных тканей, характеризуются лучшей выживаемостью и более активным ростом по сравнению с соответствующими зрелыми тканями. Причиной этого служит низкий уровень специализации и наличие реплицирующихся клеток-предшественников в эмбрионах.
Пролиферативная способность взрослых тканей ниже, они содержат больше неделящихся специализированных клеток. Получение первичных культур клеток взрослых тканей и их размножение является более сложной задачей, продолжительность жизни таких культур, как правило, невелика. Нормальные ткани дают начало культурам с ограниченным временем жизни, тогда как культуры, полученные из опухолей, способны пролиферировать неограниченно долгое время. Дифференцировка нормальных клеток в культуре сопровождается обычно полным прекращением пролиферации клеток. В культурах опухолевых клеток возможна частичная дифференцировка при сохранении способности к пролиферации.
Вопросы том, как ведут себя клетки в культуре, каковы их потребности в факторах среды и чем отличаются культивирование in vitro тканей или органов, мы рассмотрим позднее. Дополнительную информацию о культивировании животных клеток вы можете почерпнуть на сайте «Основы биотехнологии»
Источник: cbio.ru
Клеточный уровень организации жизни
Клетки являются основными структурными единицами живых организмов, поскольку именно из них они состоят. В то же время сами клетки являются биосистемами, обладающими определенной сложностью, целостностью, дискретностью, особыми свойствами и существующими по специфическим законам.
Примечательно, что ряд свойств клетка как единица особого уровня организации живой материи получила от предыдущего – молекулярного – уровня.
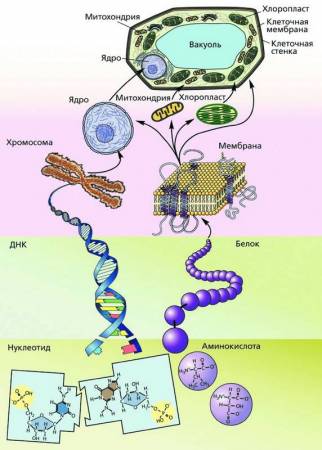
Структурные и функциональные компоненты биосистемы «клетка»
Из различных молекул сформированы все компоненты клетки, в ней протекают реакции между молекулами простых и сложных химических соединений. Поэтому многие свойства клеточного уровня организации живой материи зависят от молекулярного уровня – его компонентов и их роли в жизнедеятельности клетки. Например, молекулы ДНК несут в себе генетический код, определяющий управление процессами синтеза клеточных белков.
Однако вышестоящий уровень организации живой материи (организменный уровень) тоже оказывает влияние на свойства и повеление биосистемы клеточного уровня. Клетки, например, имеют строение и свойства, обусловленные выполнением тех или иных функций в организме. Так, клетки нервной ткани отличаются от клеток выделительной или покровной ткани.
Как правило, свойства системы одного структурного уровня жизни не только влияют на повеление систем более высокого уровня, но и сами зависят от него. Однако эта особенность уровневого взаимовлияния не отражает их полностью, поскольку каждому присущи свои отличительные свойства. Если на молекулярном уровне можно детально рассматривать процесс репликации ДНК, то на клеточном уровне его значение оценивается как проявление жизнедеятельности клетки.
Клетка, как и биосистемы любого структурного уровня, характеризуется определенными, характеризующими ее специфическими свойствами: структурой и составом компонентов, протекающими процессами, организацией их целостности, ролью в природе.
Структурными элементами клеточного уровня являются структурные части клетки – молекулы и их комплексы, создающие поверхностный аппарат, ядро и цитоплазму с органоидами. Взаимодействие между ними обеспечивает целостность клетки в проявлении ее свойств как живой системы в отношениях с внешней средой.
Основные процессы клеточного уровня, присущие только этому уровню организации жизни, возникли в ходе эволюции живой материи: обмен веществ (метаболизм); поглощение и, следовательно, включение различных химических элементов Земли в содержимое живого организма; передача наследственной информации от клетки к клетке; накопление изменений в генетическом аппарате как отражение опыта взаимодействия со средой; реагирование на раздражения при этом взаимодействии.
Организация системы клеточного уровня
В ходе эволюции сформировался особый аппарат управления процессами, протекающими в биосистеме «клетка», – это ядро с содержащимися в нем хромосомами. Впервые появляется регулирование процессов жизнедеятельности по типу прямых и обратных связей; организуется упорядоченное протекание важнейших биосинтезов с помощью матричных структур и ферментов, обеспечивающих процессы жизнедеятельности клетки.
Значение клеточного уровня организации жизни
Клетка является основной структурной единицей всех живых организмов (за исключением вирусов). Благодаря многообразию форм и функций клетка существует и как свободноживущий одноклеточный организм, и как часть многоклеточного организма, влияя таким образом на все вышестоящие уровни жизни.
Именно с клеточного уровня началась жизнь на Земле. Сочетание свойств наследственности и изменчивости организмов обусловило огромное разнообразие форм живой материи.
Значение клеточного уровня состоит также в том, что здесь начинаются процессы жизни, поскольку биологические функции ДНК и РНК, матричный синтез органических соединений, ферментативная регуляция этих процессов осуществляются только в условиях живой клетки. Вне клетки нет жизни.
Функционируя, клетка вовлекает все разнообразие химических элементов Земли в биосистемы других уровней, запасает в них солнечную энергию и тем обеспечивает все процессы жизни в биосфере.
На клеточном уровне впервые в процессе эволюции живой материи сформировалась система хранения (кодирования) и система передачи наследственной (генетической) информации от поколения к поколению, обеспечивая преемственность и непрерывность жизни.
Важное значение имеет специализация клеток, приведшая к разнообразию их свойств, происходящих в них процессов и выполняемых функций. Благодаря клеточной специализации возникли различные ткани, в процессе эволюции появились сложные многоклеточные организмы со своими особыми свойствами и способностью существования в условиях различных сред жизни на нашей планете.
Большое значение имеет и тот факт, что именно на клеточном уровне произошло появление и обособление целостной самостоятельной биосистемы в виде элементарной живой клетки. Поэтому клетка стала основной единицей и элементарной формой жизни.
На клеточном уровне в глубокой древности произошло разделение этой биосистемы на разные формы; возникли прокариоты и эукариоты, автотрофы и гетеротрофы, анаэробы и аэробы, организмы неподвижные и подвижные, имеющие половой процесс и размножающиеся иным способом.
Клеточный уровень жизни послужил ареной эволюционного поиска путем естественного отбора колониальных, многоклеточных и симбиотических форм жизни и эффективных способов размножения. На этом уровне началось эволюционное развитие организмов. Бактерии, растения, грибы, животные – все эти клеточные формы жизни ведут свое индивидуальное и эволюционное развитие от клетки.
Появление живой клетки обусловило биологический круговорот веществ и передачи энергии, чем был обозначен качественно новый этап в истории Земли – появление ее биосферы.
Клеточный уровень организации живой материи – один из основополагающих этапов существования жизни на Земле.
Таким образом, клетка является основной формой организации и элементарной единицей живой материи. Из клеток построены все живые существа (кроме вирусов). Объединение комплекса сложных биологических структур и молекул в единую, целостную, дискретную биосистему,передача наследственной информации из поколения в поколение – основные особенности клеточного уровня жизни.
Источник: blgy.ru
Перспективный метод позволяющий изучить клеточную структуру живой кожи in vivo это

Darwin Laganzon/Pixabay
Российские ученые совместно с немецкими коллегами предложили новый способ анализа спектров комбинационного рассеяния верхних слоев кожи in vivo, основанный на методах машинного обучения без учителя. Результаты исследования актуальны для дерматологического анализа или определения проникновения лекарственных веществ, доставка которых осуществляется через кожу. Статья опубликована в журнале Analyst.
Определение молекулярного состава кожи важно для многих задач медицины, фармакологии, дерматологии и косметологии. Конфокальная микроспектроскопия комбинационного рассеяния (КР) — метод, позволяющий с высокой специфичностью анализировать распределение основных молекулярных компонентов в различных подслоях кожи с микронным разрешением. Однако количественный анализ сигнала КР биотканей часто затруднен из-за схожести КР-спектров отдельных компонентов, например различных белков или липидов. Выбор неверного числа или вида базовых компонентов спектра может привести к неверному результату эксперимента.
Ученые из Научной школы МГУ «Фотоника и квантовые технологии. Цифровая медицина» и клиники Шарите предложили подход, не требующий априорных знаний о виде и распределении по глубине отдельных компонентов, основанный на разложении спектров с помощью неотрицательного матричного разложения (Non-negative matrix factorization). С помощью смоделированных и экспериментально полученных глубинно-разрешенных спектров комбинационного рассеяния верхних слоев эпидермиса in vivo ученые показали, как можно восстановить глубинные профили и спектры молекулярных компонентов, исходно присутствующих в тканях и внешних агентов.
Применение спектроскопии комбинационного рассеяния для анализа тканей перспективно для задач биомедицинской диагностики, таких как классификация здоровых и патологических тканей, определение границы опухоли. Однако иногда требуется не только классифицировать тип ткани, но и понять, изменение каких молекулярных составляющих приводит к наблюдаемым изменениям сигнала. Поэтому требуются новые подходы к анализу данных, результаты которых должны быть хорошо интерпретируемы и при этом не иметь жестких ограничений в модели.
« В данной работе мы показали, что метод неотрицательной матричной факторизации отлично справляется с анализом данных комбинационного рассеяния реальных тканей на примере кожи. Основываясь только на экспериментальных полученных спектрах комбинационного рассеяния, без каких-либо дополнительных предположений о том, какие вещества содержатся в коже, метод неотрицательной матричной факторизации позволил легко разделить отдельные молекулярные компоненты. Эта информация может быть значима, например, для дерматологического анализа или определения проникновения лекарственных веществ, доставка которых осуществляется через кожу», — рассказывает соавтор исследования Борис Якимов.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.
Источник: inscience.news
