б)кожно-аллергические пробы отличаются временем- и критериями оценки при учете: максимум их развития наблюдается через 24-48-72 часа. Реакция считается положительной при наличии инфильтрата на месте введения размером более 5 мм;
в)реакция подавления миграции макрофагов. Лимфоциты человека смешивают с предполагаемым антигеном, а через 18 часов в каплю полученной культуральной жидкости опускают капилляр, наполненный подвижными макрофагами или гранулоцитами и через, сутки измеряют степень их миграции из опытного и контрольного (без антигена) капилляров. Их отношение называется индексом подавления миграции.
г)реакция бластной трансформации лимфоцитов с фитогешгглютинлном или соответствующими антигенам проявляется в превращении лимфоцитов в более крупные молодые клетки — бласты, число которых подсчитывается в препарате на 200 лимфоцитов.
38. Иммунологическая толерантность. Определение, механизмы, биологическое значение.
Иммунологическая толерантность — неспособность организма специфически отвечать на действие антигена. Лежит в основе функционирования иммунной системы в норме и обеспечения ее ареактивности по отношению к антигенам тканей собственного организма.
Want to know how to correlate in vitro and in vivo data?
Это явление было открыто П.Медаваром на мышах. В результате экспериментов оказалось, что врожденная толерантность к антигену (толерогену) возникает, когда происходит внутриутробный контакт организма с этим антигеном. В этом случае организм после рождения будет воспринимать данный АГ как «свое». В настоящее время такая толерантность объясняется тем, что в эмбриогенезе происходит гибель клонов-предшественников Т-лимфоцитов, способных взаимодействовать с толерогеном.
Кроме врожденной, существует также и приобретенная толерантность. Чаще всего это обратимый процесс. Приобретенная толерантность бывает 2-х видов’: высокодозовая и низкодозовая. Высокодозовая толерантность возникает при попадании в организм больших доз толерогена, особенно введенного на фоне подавления иммунитета (облучение, применение иммунодепресантов).
Такое большое количество АГ вызывать гибель реактивных к нему лимфоцитов. Низкодозовая толерантность возникает при введении малых доз определенных АГ. Считается, что в данном случае она опосредована активацией клеток-супрессоров, подавляющих иммунную реакцию. В целом же в настоящее время оба механизма поддержания толерантности (делеция клонов и их супрессия) рассматриваются как взаимодополнияющие.
Анергия — неотвечаемость на антиген, это обычно вариант высокодозовой толерантности на фоне подавления иммунного ответа.
39. Трансплантационный иммунитет. Антигены гистосовместимости I, II, III классов, роль в иммунном ответе. Типы трансплантационных реакций. Механизмы отторжения трансплантата.
Предупреждение.
возникает примерно через 1—2 нед. после трансплантации и сохраняется в течение от 1 мес. до нескольких лет. На протяжении этого периода повторная трансплантация сопровождается отторжением пересаженной ткани в более короткий срок.
In Vitro In Vivo (IVIV) Correlations
Сенсибилизация обусловлена в первую очередь реакцией регионарных к трансплантату лимфатических узлов, через которые происходит отток лимфы от пересаженной ткани: далее включаются другие участки лимфоидной ткани хозяина. Иммунитет при_ аллотрансплантациях не обладает органной специфичностью, реакция имеет индивидуально специфический характер.
Она направлена как против той ткани, которая пересаживалась, так и против других тканей того же донора. Основным клеточным компонентом при этом является Т-популяция стимулированных лимфоцитов, хотя гуморальные факторы реципиента также принимают участие в формировании трансплантационного иммунитета.
В период реакции тканевой несовместимости установлено появление в крови реципиента антител, оказывающих комплементзависимое цитотоксическое, а также агглютинирующее действие на клетки донорской антигенной принадлежности. Антитела обнаружены также в трансплантате во время его гибели Полной ясности в механизме отторжения трансплантатов еще нет. Полагают, что генетически чужеродный трансплантат отторгается в результате инфильтрации пересаженной ткани лимфоцитами — Т-киллерами, которые оказывают разрушающее действие на клетки-мишени, выделяя биологически активное вещество — лимфотоксин. Разрушение лимфоцитами усиливается при воздействии иммунных антител (антителозависимый цитолиз).
В результате клеточной инфильтрации местно (в области трансплантата) достигается высокая концентрация иммунологических эффекторов, приводящая к его гибели. Иммунологическая реакция при пересадке аллогенных клеток может иметь прямо противоположную форму и исходить со стороны иммунокомпетентных клеток пересаженной ткани против организма реципиента — реакция трансплантата против хозяина (РТПХ). Эта реакция наблюдается преимущественно при трансплантации костного мозга, когда иммунная реактивность реципиента понижена.
Антигены главного комплекса гистосовместимости (МНС — Major histocompatibility complex). МНС у человека называются HLA (англ. Human leucocyte antigene). Молекулы гистосовместимости I и II классов кодируются генами системы гистосовместимости локусов А, В, С и D, которые располагаются в коротком плече 7 хромосомы. Они характеризуются выраженным разнообразием.
Молекулы 1 класса состоят из тяжелой цепи (45 кДа) нековалентно связанной с В-2 микроглобулином (12 кДа). Они могут быть фиксированы на мембране клеток, так и обнаруживаться в сыворотке и других жидкостях организма. Тяжелая цепь молекулы состоит из 3-х внеклеточных доменов, обозначенных — al (N-терминальный), а2 и аЗ, трансмембранной области и цитоплаэматического хвоста. Они экспедированы как на иммунокомпетентных, так и на соматических клетках.
Выявлено участие растворимых молекул I класса в различных этапах иммунного ответа: а) связывании антиНЬАантител; б) ингибиции цитотоксичности аутореактивных Т-лимфоцитов; с) формировании иммунологической толерантности.
Молекулы II класса распознавания являются продуктами DR, DQ и DP генов, гетеродимеры тяжелой (а) и легкой (в) гликопротеидных цепей. Молекулярная масса альфа цепи 30-34 кДа, а бэта — 26-29 кда. Внеклеточная часть молекулы представлена al и а2, или в1 и в2 и соединена небольшой трансиенбранной областью (30 аминокислот) и коротким цитоплазматическин доменом (15 аминокислот).
Они экспрессированы преимущественно на мембране иммунокомпетентных клеток. Антигены МНС I класса имеют все ядросодержащие клетки, а МНС II класса — только антигенпрезентирующие клетки. Антигены МНС I и II классов участвуют в презентации (представлении) клетками антигенного пептида Т-лимфоцитам: продукты МНС I класса презентируют (представляют) антигенный пептид CD8+ Т-лимфоцитам, а МНС II класса CD4+ Т-лимфоцитам. Имеются неклассические молекулы МНС, или МНС-подобные (например, CD1). Виды и механизмы реакций отторжения: раннее отторжение трансплантата
Основной механизм отторжения — клеточно опосредованный. Иммунный ответ похож на таковой при туберкулиновой пробе, вызывает разрушение трансплантата в течение дней — месяцев. Гистологически характеризуется мононуклеарной клеточной инфильтрацией трансплантата, кровоизлияниями и отеком. Из — за гипоксии нередко развивается фиброз. Такой вид отторжения можно затормозить с помощью иммуносупрессоров.
позднее отторжение трансплантата. Проявляется в основном у пациентов с ИДС. Патологическая картина отличается от (1.) тем, что вовлекается эндотелий сосудов, происходит его пролиферация с последующим сужением просвета сосудов, что приводит к ишемии и некрозу трансплантата. гипериммунное отторжение трансплантата
Проявляется в случаях, если антигены трансплантата раньше уже попадали в организм реципиента до текущей пересадки (при беременности, переливании крови, предыдущей трансплантации). Отторжение и деструкция развиваются в течение часов и даже минут. Реакция опосредована гуморально, характеризуется тромбозом мелких сосудов, инфарктом трансплантата, лизисом клеток на границе » трансплантат — хозяин». Процесс необратим и не предотвращается ни одним из известных методов иммуносупрессии.
Для предупреждения развития реакций отторжения необходимо:
типирование тканей по МНС, ABO, Rh; исключить » специфическую презентацию» – предыдущее попадание антигена трансплантата в организм хозяина; проводить иммуносупрессивную терапию до приживания трансплантата.
Источник: lektsia.com
in vitro
Латинский термин, означающий в стекле. Следовательно, употребляется в отношении биологических или физиологических тестов или экспериментов, проводимых скорее в изоляции (например, в пробирке), чем в целом организме. Противопоставляется in vivo.
Найдено научных статей по теме — 15
Исследование спонтанной и индуцированной продукции цитокинов in vitro у больных с аллергопатологией
Зурочка А. В., Квятковская С. В., Дворчик Е. Е., Шестакова Е. В., Бастрон А. С.
Исследование противоопухолевого механизма действия бетулиновой кислоты и ее производных in vitro
Шинтяпина А. Б., Борисов В. И., Шульц Э. Э.
Разработка и испытания in vitro неорганических нанобиоматериалов в качестве матриксов для клеточных
Сергеева Н. С., Решетов И. В., Баринов С. М., Штанский Д. В., Самойлович М. И., Свиридова И. К., Кирсанова В. А., Ахмедова С. А., Комлев В. С., Фадеева И. В., Клещева С. М., Филюшин М. М.
Изучение вирус-индуцированного апоптоза опухолевых клеток in vitro
Видяева И. Г., Уразова Л. Н., Кузнецова Т. И.
В работе показана способность вакцинных штаммов вирусов осповакцины, паротита и венесуэльского энцефаломиелита индуцировать апоптоз опухолевых клеток в системе in vitro.
Продукция интерлейкина-1 бета и фактора некроза опухоли альфа in vivo и in vitro у ликвидаторов посл
Сысоев Кирилл Александрович, Калинина Н. М., Бахтин М. Ю., Никифоров А. М.
Оценка эквивалентности in vitro генерических лекарственных средств кетопрофена
Кулинич Ю. И.
Изучение токсичности лекарственных средств in vitro при оценке их токсикологического взаимодействия
Гуськова Т. А., Сюбаев Р. Д., Немкова И. Н., Енгалычева Г. Н.
10-10м GP-Sh2 — модификатор МЛУ in vitro, in vivo
Ибрагимов А. А., Тонких А. К., Аскарова З. Ш., Кадырова Д. А.
Тесты in vitro для прогноза течения колоректального рака
Бритвина В. А., Шелапутина З. Ф., Герасимова Г. К., Пророков В. В.
Оценка фунгицидной активности различных СИСТЕМНЫХ АНТИМИКОТИКОВ IN VITRO
Желтикова Т. М., Глушакова А. М.
Грибы (дрожжи, микромицеты) оказывают многофакторное воздействие на организм человека. Они могут быть причиной токсических и аллергических реакций, а также способствовать формированию микозов.
Ранние проявления иммуномодулирующего действия коревой вакцины в эксперименте in vitro
Ляшенко Всеволод Андреевич, Александер С. К., Ковалева Л. Г., Лавров В. Ф., Юминова Н. В.
Исследовано два вида иммуномодулирующего действия вируса коревой вакцины in vitro: влияние на уровень бласттрансформации лимфоцитов крови, индуцированной ФГА, и воздействие на некоторые функции гранулоцитов: адгезивную способность
Аллергическая альтерация лейкоцитов in vitro при пенициллиновой аллергии
Гервазиева Валентина Борисовна, Степанова Е. В., Гюнтер Е. А., Сверановская В. В., Жирова С. Н., Воробьева Н. Л.
С помощью теста альтерации лейкоцитов определяли наличие повышенной чувствительности к бензилпенициллину и ампициллину у 428 больных, имевших в анамнезе аллергические реакции к этим препаратам.
Источник: vocabulary.ru
Определение вирулентности in vivo и in vitro
Гидронефроз — скопление жидкости в полости, образовавшейся в почке. Разновидностью гидронефроза или начальной стадией его является изменение, которое правильнее называть уронефроз, т. е. скопление мочи в растянутой лоханке (пиэлоэктазия). Для скопления жидкости и образования вместилища для нее должны создаться определенные условия.
Патогенные микробы, вирулентность и токсигенность
Возбудителями инфекционных заболеваний человека и животных являются болезнетворные или патогенные микробы. Патогенность — это видовой признак микроба. Среди болезнетворных микробов различают монопатогенные виды, способные вызывать инфекционное заболевание у одного вида животных или у человека.
Так, бледная трепонема, брюшнотифозная палочка, гонококк вызывают заболевания только у человека. Если патогенность распространяется на многие виды животных и человека, то такие микробы называют полипатогенными (сибиреязвенная палочка, бактерии туляремии, вирус бешенства и др.).
Между патогенными и непатогенными микробами находится промежуточная группа так называемых условно-патогенных микробов. Представители этой группы способны вызывать инфекционные процессы только при определенных условиях — при снижении сопротивляемости организма, при попадании в организм очень большого количества микробов и т. д.
У патогенных микробов степень болезнетворного действия — вирулентность — может изменяться под влиянием различных условий. Для повышения вирулентности можно использовать пассажи через организм высоковосприимчивого животного. К снижению вирулентности приводят длительное культивирование на искусственных средах, пассажи через маловосприимчивый организм, влияние различных неблагоприятных факторов. Вирулентность бактерий связывают с образованием токсинов, со способностью к капсулообразованию, с наличием некоторых ферментов (гиалуронидаза, фибринолизин, коагулаза и др.). Наличие у микроба способности продуцировать эти вещества дает микробу возможность преодолевать защитные механизмы организма (бактерицидность крови, непроницаемость соединительной ткани, фагоцитарная защита и др.) и, таким образом, благоприятствует быстрому размножению и распространению возбудителя в макроорганизме.
Токсическое действие микробов обусловливается их способностью образовывать экзо- и эндотоксины.
Экзотоксины, выделяемые бактериальной клеткой при жизни в окружающую среду, являются веществами белковой природы. Они нестойки, сильно ядовиты и обладают избирательностью действия на определенные органы и ткани (гемотоксины, нейротоксины и др.). Получают экзотоксины большей частью путем фильтрования бульонной культуры через бактериальные фильтры.
О степени токсичности экзотоксина судят по величине минимальной смертельной дозы Dosis letalis minima (Dim), вызывающей гибель определенного вида лабораторного животного. Микробы, продуцирующие экзотоксин, называются токсигенными. К ним относятся возбудители столбняка, дифтерии, ботулизма и др.
Эндотоксины тесно связаны с цитоплазмой микробной клетки и поэтому могут быть получены только после гибели и разрушения клетки. Эндотоксины являются веществами сложной химической природы (полисахаридополипептидо-липоидные комплексы), они термостабильны, менее ядовиты, чем экзотоксины, и не обладают избирательностью действия (тропизмом). Для получения эндотоксинов пользуются различными методами, в основу которых положено разрушение микробной клетки.
В возникновении и развитии инфекционного процесса имеют значение не только свойства и количество проникающего в организм патогенного микроба, но и состояние реактивности макроорганизма.
В течение инфекционного заболевания микроб-возбудитель находится в организме больного и в большинстве случаев может быть выделен в чистой культуре или обнаружен микроскопическим путем. Локализация возбудителя в организме зависит как от свойств возбудителя, так и от состояния макроорганизма. Микробы могут распространяться в организме гематогенным, лимфогенным и нейрогенным путями. Многие микробы обладают органотропностью, то есть поражают определенные органы и ткани. Например, менингококк поражает мозговые оболочки, холерный вибрион — тонкий кишечник и т. д.
По локализации возбудителя и путям его распространения различают следующие основные формы инфекций: токсинемия, когда возбудитель размножается во входных воротах, а выделяемый им токсин током крови разносится по организму, поражая органы и ткани, к которым он обладает тропизмом; местная или локализованная инфекция характеризуется размножением возбудителя в пределах входных ворот; бактериемия — циркуляция возбудителя в кровяном русле; септицемия или сепсис — общее заболевание, характеризующееся поступлением возбудителя в кровь из очага инфекции (рана, родовые пути, гнойные процессы).
Очень большое значение для постановки диагноза инфекционного заболевания имеют микробиологические исследования. Микробиологический диагноз основан на выделении предполагаемого возбудителя из организма больного. Для постановки микробиологического диагноза необходимо знать локализацию возбудителя при каждом инфекционном заболевании. Так, при локализованных гнойных инфекциях исследованию подвергается гной, при кишечных инфекциях — испражнения больного, при сепсисе для исследования берут кровь больного.
При постановке микробиологического диагноза может быть использован метод микроскопии (микроскопия препаратов из исследуемого материала), бактериологический метод — выделение чистой культуры и ее идентификация, биологический метод — заражение исследуемым материалом лабораторных животных. При гибели лабораторных животных производят бактериологическое исследование трупа.
Экспериментальное заражение лабораторных животных имеет большое значение и часто используется для определения вирулентности возбудителя, определения силы токсина, титрования сывороток и других видов научной и практической работы. В качестве лабораторных животных используют белых мышей, морских свинок, кроликов, реже ставят опыты на других видах животных. Заражение экспериментальных животных производят различными путями: под кожу, внутрикожно, накожно, внутрибрюшинно, внутривенно, через пищеварительный тракт и др.
На практических занятиях студенты проводят определение вирулентности бактериальной культуры. В связи с тем что при различных способах заражения Dim будет различной, заранее устанавливают способ заражения животного. Для определения вирулентности используют суточную агаровую культуру Klebsiella pneumoniae. В пробирку с агаровой культурой стерильной пипеткой наливают 3 мл изотонического раствора хлорида натрия, которым смывают культуру, вращая пробирку между ладонями. Стерильной пипеткой переносят смыв в стерильную пробирку и приготовляют взвесь, содержащую в 1 мл 1 млрд, микробных клеток.
Для стандартизации (определения количества микробных клеток в 1 мл) пользуются оптическим стандартом мутности, изготовляемым в Государственном научно-исследовательском институте стандартизации и контроля биологических препаратов им. Л. А. Тарасевича (ГИСК).
Оптический стандарт (стеклянный) состоит из ряда пробирок, содержащих от 5 до 10 единиц мутности (10 единиц мутности соответствует 1 млрд, взвеси брюшнотифозных или 10 млрд, взвеси коклюшных бактерий, что зависит от различной величины этих микробов). К набору бактериальных стандартов приложена пробирка, по размерам полностью соответствующая пробиркам со стандартами.
В эту пробирку наливают 1 или 2 мл исходной микробной взвеси, к которой постепенно прибавляют изотонический раствор хлорида натрия до получения одинаковой мутности с выбранным стандартом. При определении мутности пробирку со взвесью и соответствующий стандарт держат против света на фоне специального печатного шрифта. Из полученной одномиллиардной взвеси (10 единиц мутности) приготовляют разведения в 2, 4 и 8 раз, для чего берут три пробирки, содержащие по 1 мл изотонического раствора хлорида натрия. В первую пробирку вносят 1 мл исходной взвеси. Путем переноса из первой пробирки 1 мл во вторую и из второй в третью приготовляют взвеси, содержащие 500 млн., 250 млн. и 125 млн. микробов в 1 мл.
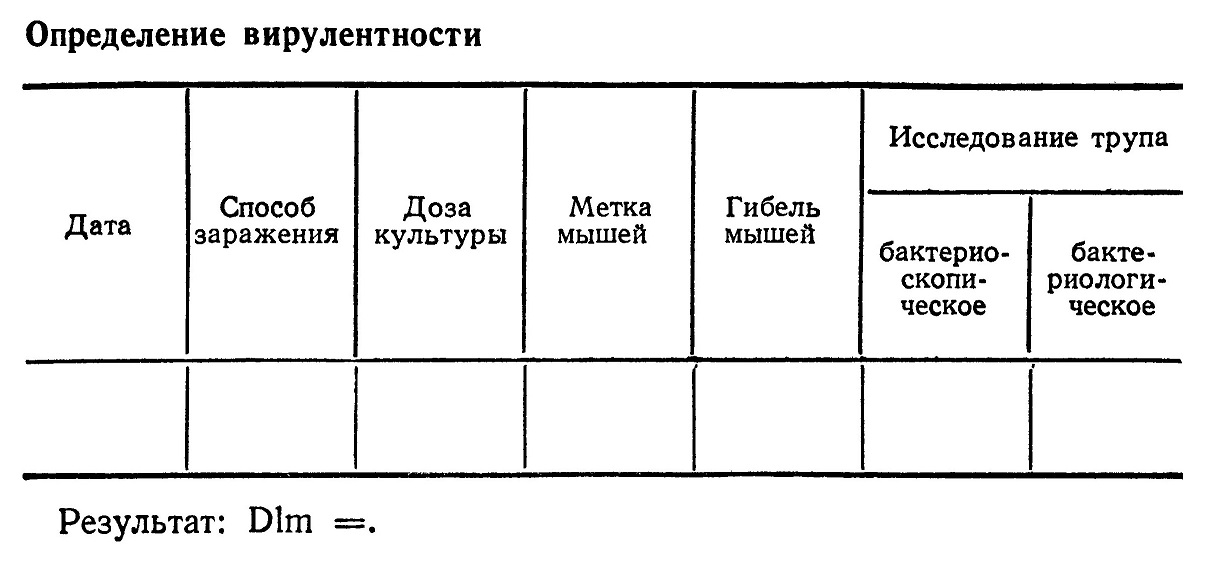
Для определения минимальной смертельной дозы мышей заражают внутрибрюшинно или подкожно определенной дозой культуры в объеме 0,5 мл. Для большей точности определения Dim каждой дозой заражают 3— 5 мышей. Протокол опыта записывают по прилагаемой форме (табл.).
При внутрибрюшинном заражении мышь фиксируют головой вниз, чтобы внутренние органы переместились ближе к диафрагме; при подкожном заражении захватывают складку кожи на спине животного. Заражение животных следует производить осторожно во избежание попадания патогенных микробов на руки и окружающие предметы.
Для этого следует при наполнении шприца, опуская иглу во взвесь микробов, медленно набирать жидкость во избежание появления в шприце пузырьков воздуха. Пузырьки воздуха удаляют из шприца, повернув шприц иглой кверху, и, покрыв кончик иглы кусочком ваты, выталкивают в нее пузырьки. Вату сбрасывают в дезинфицирующий раствор. Зараженных мышей наблюдают в течение 3 дней, после чего производят учет результатов. Трупы мышей подвергают бактериоскопическому и бактериологическому исследованию.
Трупы мышей фиксируют на специальных столиках, поверхность кожи смачивают спиртом или дезинфицирующим раствором. Вскрытие производят послойно: сначала по средней линии делают разрез кожи, отсепаровывают ее, а затем стерильными инструментами (погруженными в спирт и обожженными) вскрывают грудную полость.
Поверхность сердца прижигают накаленным скальпелем, после чего через обожженную поверхность при помощи тонкой пастеровской пипетки берут каплю крови. Посев крови производят в пробирку с мясопептонным бульоном и чашку с мясопептонным агаром и приготовляют препарат для бактериоскопии.
Затем вскрывают брюшную полость, стерильно отсекают кусочки селезенки и поверхностью разреза производят посев на чашку с мясопептонным агаром, а также готовят мазки — отпечатки для бактериоскопии. Препараты после подсушивания фиксируют на пламени горелки, окрашивают водным фуксином и микроскопируют. Посевы помещают в термостат. Результаты учитывают на следующем занятии.

Бактериальные токсины изучают в опытах in vivo и in vitro. На занятиях демонстрируется мышь, зараженная накануне столбнячным экзотоксином. Столбнячный нейротоксин, введенный животному в дозе 1 Dim внутримышечно в заднюю лапку, вызвал типичную картину столбнячной интоксикации — спастическое сокращение мышц задней конечности и хвоста («хвост дугой», рис.).
Гемотоксин стафилококка и других микробов может быть обнаружен путем посева на кровяные среды. На занятии демонстрируется чашка Петри с кровяным агаром, засеянная культурой стафилококка. Гемотоксин диффундирует в окружающую среду, вызывая гемолиз эритроцитов— колонии микроба окружены прозрачной зоной гемолиза.

Занятие 1-е. Вакцины и анатоксины.
Источник: med-microbiology.com
