Окислительное прямое Непрямое (трансдезаминирование) Неокислительное Внутримолекулярное?
Основной вид дезаминирования
Прямое ОД характерно для
Глутаминовой кислоты
Фермент прямого ОД
Глутаматдегидрогеназа
Кофермент прямого ОД
НАД -> НАДН*Н+
Прямое ОД протекает
В печени, для получения аммиака и его дальнейшего превращения в мочевину
Механизм прямого ОД
2 стадии, с образованием иминоглутарата, затем а-кгк
Непрямое ОД характерно для
Большинства аминокислот, которые не могут дезаминироваться в 1 стадию
Фермент и кофермент непрямого ОД
Аминотранфераза (ПФ), глутаматдегидрогеназа (НАД)
Механизм непрямого ОД
2 стадии — трансаминирование на а-кгк, дезаминирование глутаминовой кислоты
Неокислительное дезаминирование характерно для
Серина, треонина, триптофана
Механизм неокислительного дезаминирования
Отщепление воды и образование метиленовой группы, образование иминокислоты, кетокислоты
Переваривание белков. Трансаминирование АСТ АЛТ. Дезаминирование. Коэффициент де Ритиса
Серин = -Н2О = метиленовая группа Метиленовая группа = перераспределение Н+ (связи) = иминокислота иминокислота = + Н2О — NH3 = ПВК
Треонин = — Н2О = метиленовая группа Метиленовая группа = перераспределение Н+ (связи) = иминокислота Иминокислота = +Н2О — NH3 = а-кетобутират
Гистидин = гистидаза — NH3 = уроканиновая кислота
Источник: flashcards-library.com
Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:

Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD + ).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование — основной способ дезаминирования большинства аминокислот.Обе стадии непрямого дезаминирования обратимы , что обеспечивает как катаболизм аминокислот , так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты .
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение — дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:
АМИНОКИСЛОТЫ 1: ПЕРЕВАРИВАНИЕ БЕЛКОВ, ТРАНСАМИНИРОВАНИЕ АК, ДЕЗАМИНИРОВАНИЕ АК

Можно выделить 4 стадии процесса:
- трансаминирование с α-кетоглутаратом, образование глутамата;
- трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;
- реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
- гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом .
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы .


Рис. 9-9. Биологическая роль непрямого дезаминирования. А — при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты.
Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б — при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
Источник: studopedya.ru
Окислительное дезаминирование глутаминовой кислоты in vivo биологическая роль
Доступные субстраты для получения углерода, азота и энергии — аминокислоты, пурины и пиримидины. Как аэробные, так и анаэробные бактерии используют эти соединения для синтеза белка либо непосредственно, либо после ряда превращений и вовлечения в промежуточный обмен.
Аминокислоты. Декарбоксилирование и дезаминирование аминокислот бактериями. Механизм Стиклэнда.
Декарбоксилирование и дезаминирование аминокислот. Первой реакцией катаболизма аминокислот может быть декарбоксилирование либо дезаминирование. Декарбоксилазы действуют обычно в кислой среде, образуя С02 и первичные амины (так называемые биогенные амины, трупные яды — кадаверин, путресцин, агматин). Поскольку при этом высвобождаются основные группы (амины), то такой процесс рассматривают как механизм нейтрализации среды и сохранения рН в физиологических пределах.
Дезаминирование аминокислот идёт с выделением аммиака. В зависимости от судьбы углеродного скелета различают дезаминирование окислительное (наиболее распространённое, например, превращение глутаминовой кислоты в 2-оксоглутаровую), гидролитическое и приводящее к образованию ненасыщенных соединений.
Ферменты, катализирующие эти реакции, обычно специфичны для D- и L-изомеров аминокислот. Углеродные фрагменты, не содержащие азота, используются в процессах брожения или дыхания. Если в состав аминокислот входит сера, то последняя обычно высвобождается в форме сероводорода или меркаптанов.
Разложение ароматических аминокислот (например, триптофана) происходит с образованием индола и скатола. У некоторых микроорганизмов в качестве источников энергии могут использоваться лишь некоторые продукты дезаминирования. Например, эшерихии и протеи дезаминируют триптофан с образованием индола и пирувата, из которых лишь последний утилизируется как источник энергии. Поскольку индол накапливается в культуре, то его наличие легко обнаруживают с помощью реактива Эрлиха (смесь л-диметиламинобензальдегида и НСl в этаноле), что используют для идентификации бактерий на практике.
• Некоторые бактерии обладают специальными механизмами получения энергии при расщеплении аминокислот. Например, аргинин расщепляет аргининдегидролазная система, состоящая из нескольких ферментов. Первоначально аргининдезаминаза катализирует его превращение в цитрул-лин, затем последний превращается в орнитин через реакцию, сопряжённую с синтезом АТФ.
• На средах, содержащих смесь аминокислот, многие клостридии получают большую часть энергии не из отдельных компонентов, а путём сопряжения окислительно-восстановительных реакций между парами подходящих аминокислот, известного как механизм Стиклэнда. С этих позиций аминокислоты можно разделить на акцепторы (глицин, орнитин, пролин) и доноры водорода (аланин, изолейцин и валин). Первоначально донор окисляется до кетокислоты, затем «доокисляется» до жирной кислоты. Образующийся при этом НАДН+ утилизируется для восстановления другой аминокислоты — акцептора (или, реже, другого азотистого соединения).
Переаминирование аминокислот. Кроме реакций дезаминирования и декарбоксилирования, аминокислоты могут подвергаться переаминированию, то есть переносу целой аминогруппы от аминокислоты к а-кетокислотам без промежуточного образования аммиака. Участвующая в переамини-ровании аминокислота (донор аминогруппы) превращается в а-кетокислоту
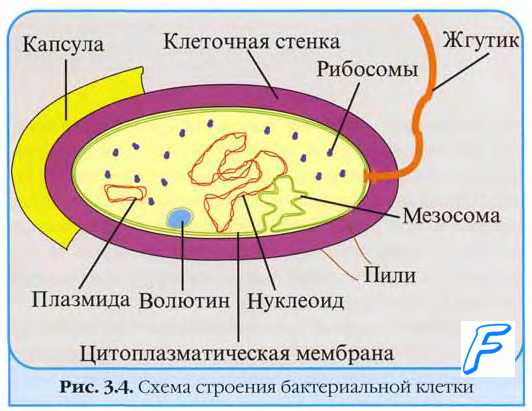
Пурины и пиримидины
Пурины и пиримидины становятся доступными для энергетического метаболизма лишь после гидролиза нуклеотидов и нуклеозидов. В результате их разложения образуются углекислота, аммиак, муравьиная, уксусная и молочная кислоты, часть из которых включается в рассмотренные выше энергетические пути.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Источник: meduniver.com
